Metano
Proprietà e caratteristiche del metano
Il metano è un idrocarburo che appartiene alla famiglia degli alcani; è formato da un atomo di carbonio e quattro atomi di idrogeno. Ha formula chimica CH4.
Descritto nel 1776 da Alessandro Volta come aria infiammabile nativa delle paludi (poiché viene prodotto dalla decomposizione della vegetazione in zone umide e in assenza di aria), diversa dalla comune aria infiammabile di Cavendish* (idrogeno), fu per qualche tempo noto con la denominazione di gas delle paludi.
La sua composizione chimica fu stabilita da Berthollet (1785), Henry (1805) e J. Dalton (1805).
Nei primi decenni del secolo XIX fu riconosciuta la presenza del gas delle paludi nei gas naturali ed in altre manifestazioni endogene come pure nel grisou delle miniere carbonifere.
La formazione del metano nelle paludi, riferita da tempo alla decomposizione di materiali legnosi, fu attribuita da Hoppe-Seyler alla fermentazione anaerobica della cellulosa:
C6H10O5 + H2O →3 CO2 + 3 CH4
La prima sintesi totale del metano fu fatta da M. Berthelot facendo passare su rame riscaldato al calor rosso vapori di solfuro di carbonio e di idrogeno solforato:
CS2 + 2 H2S + 8 Cu → 4 Cu2S + CH4
Struttura della molecola del metano
Nel XIX secolo fu stabilito che la geometria della molecola del metano è quella di un tetraedro regolare con gli idrogeni ai quattro vertici, il carbonio al centro e gli angoli tra due legami chimici qualsiasi pari a 109,5°. L'atomo di carbonio è ibridato sp3.
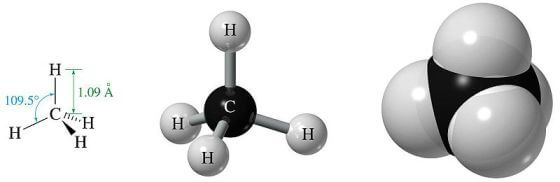
Le prove della struttura del metano si basano sul fatto che tutti e quattro gli idrogeni risultano essere geometricamente identici.
Proprietà del metano
Il metano è un gas inodore, incolore, insapore, non tossico, che brucia all'aria con fiamma bluastra poco luminosa. La reazione di combustione è la seguente:
CH4 + 2 O2 → CO2 + 2 H2O
Il metano ha un potere calorifico superiore di 9520 kcal/Nm3, inferiore di 8550 kcal/Nm3.

Si noti la fiamma bluastra ottenuta nella combustione del metano.
È praticamente insolubile in acqua, mentre si scioglie nei solventi organici.
Bolle a -162°C e fonde a -183°C; forma con l'aria, l'ossigeno ed il cloro miscele tonanti.
È assai stabile al calore e subisce la pirolisi (C + 2 H2) verso 1000°C, mentre in presenza di catalizzatori (nichel, cobalto), la reazione avviene intorno a 500°C.
Il metano forma con gli alogeni prodotti di sostituzione; importante per l'industria è l'alogenazione diretta (per approfondimenti si veda: alogenazione degli alcani).
Industria del metano
Attualmente l'industria del metano è fondata sulla utilizzazione delle seguenti materie prime:
- gas naturali (metano naturale);
- liquami di fognatura (metano biologico);
- gas di cokeria;
- gas di raffineria e di cracking degli olii minerali.
Data la quantità delle materie prime di cui si dispone, non è conveniente ricorrere a procedimenti sintetici di preparazione; l'idrogenazione catalitica dell'ossido di carbonio a metano, talvolta praticata in alcuni impianti di gas domestico, può avere importanza per lo "svelenamento" del gas o per trasformare in metano le ultime tracce di ossido di carbonio nel gas di sintesi dell'ammoniaca a monte dei reattori chimici di catalisi.
L'unica sorgente veramente considerevole del metano è quella dai gas naturali combustibili; il gas di cokeria (ottenuto per distillazione secca di alcuni tipi di litantrace) dà metano a prezzi economici solo se si procede alla liquefazione per separare l'idrogeno, mentre i gas di raffineria e di cracking, dopo aver separato gli idrocarburi C2—C4, danno metano che viene adoperato per usi termici negli stabilimenti o anche ceduto alle officine di gas domestico.
Il metano da gas naturali (metano naturale) costituisce il componente principale dei gas naturali combustibili, i quali si ritrovano in giacimenti da soli o insieme al petrolio.
Produzione e utilizzazione del metano
Il metano è comunemente usato come combustibile industriale e domestico, dato il suo elevato potere calorifico e la possibilità di trasporto abbastanza economico.
Per il suo potenziale termico, relativamente elevato, il metano viene impiegato come carburante per autotrazione, compresso in bombole a circa 200 atm.

Distributore di metano
Altri impieghi del metano riguardano la grande industria chimica e la possibilità della sua conversione in idrogeno e quindi in ammoniaca e fertilizzanti.
Altre sue utilizzazioni chimiche su grande scala sono la fabbricazione di nerofumo, di acido cianidrico e di acetilene.
Dal metano si preparano anche i suoi derivati clorurati: cloruro di metile, cloruro di metilene, cloroformio e tetracloruro di carbonio per reazione diretta con cloro e frazionamento dei prodotti ottenuti, insieme ad acido cloridrico.
Tappe della metanochimica
1776 - Alessandro Volta lo descrive come gas delle paludi, la sua composizione verrà stabilita in seguito da Berthollet (1785) e da Henry e J. Dalton (1805).
1837 - Persoz ottiene il metano da acetato sodico e idrossido alcalino, reazione chiarita poco dopo da Dumas.
1839 - Studio della reazione tra metano e cloro.
1856 - Sintesi di Berthelot del metano da solfuro di carbonio e idrogeno solforato in presenza di rame.
1859 - Inizio della valorizzazione in U.S.A. del gas naturale insieme al petrolio.
1860 - Reichhardt trova il metano tra i gas delle miniere saline di Stassfurt. Berthelot ottiene acetilene dal metano.
1862 - Ruge scopre il metano tra i gas che si formano negli organismi animali.
1863 - Decomposizione termica del metano in carbonio e idrogeno.
1865 - A. W. Hofmann dà al gas delle paludi il nome di metano.
1870 - Negli U.S.A. viene prodotto il nerofumo dal metano naturale.
1879 - Liquefazione del metano.
1894 - Formazione di metano per azione dell'acqua sul carburo di alluminio.
1897 - Sintesi del metano da carbonio e idrogeno a 1200°C per mezzo di una reazione di equilibrio.
1900 - Ricerche di Omelianski sulla formazione del metano per fermentazione putrida e caratterizzazione dei batteri metanigeni.
1902 - Formazione del metano per idrogenazione catalitica dell'ossido di carbonio e dell'anidride carbonica. Formazione di aldeide formica per ossidazione parziale del metano.
1906 - Formazione del gas d'acqua per ossidazione parziale del metano.
1911 - Sintesi dell'acido cianidrico da metano e azoto.
1922 - Sintesi dell'acido cianidrico da metano e ammoniaca.
1925 - Decomposizione del metano con il vapor d'acqua a 800-1000°C con formazione di CO + 3 H2 e CO2 + 4H2.
1927 - Reazione del metano con zolfo in presenza di catalizzatori per ottenere solfuro di carbonio. Realizzazione industriale della sintesi dell'acido cianidrico da metano e ammoniaca.
1929 - Formazione di alcool metilico per ossidazione del metano.
1931 - Formazione del gas di sintesi per reazione di 2 vol. di metano e 1 vol. di ossigeno a 850-900°C, in presenza di nichel e di torina.
1934 - Reazione del metano con anidride solforosa per ottenere solfuro di carbonio.
1936 - Realizzazione industriale ad Alberta (Canada) dell'ossidazione del metano ad alcool metilico.
1943 - Procedimento Hass di nitrazione diretta del metano.
1950-1971 - Crescente sviluppo dell'industria del gas naturale e della rete dei metanodotti in Europa.
* fisico francese noto per l'esperimento che porta il suo nome (esperimento di Cavendish).
Link correlati:
A quanti litri corrisponde un kg di metano?
A quanti litri corrisponde un metro cubo di metano?
Quanto vale il PCI del metano?
Qual è il peso in kg e in grammi di un metro cubo di metano?
Studia con noi