Orbitale di Tipo p
Caratteristiche dell'orbitale p
L'orbitale di tipo p è un orbitale a forma di doppio lobo per il quale il numero quantico secondario l è uguale a 1.

Orbitale di tipo p
L'orbitale di tipo p ha l'aspetto di due lobi tangenti e simmetrici rispetto al nucleo (posto nel punto di tangenza) entro i quali l'elettrone ha la stessa probabilità di trovarsi.
Per l = 1, il numero quantico magnetico m assume tre possibili valori (-1, 0, +1) che indicano tre diverse orientazioni nello spazio dell'orbitale e precisamente lungo i tre assi cartesiani ortogonali x, y, z.
Il sottolivello p è dunque formato da tre orbitali ortogonali tra loro indicati con le sigle px, py, pz come nella figura seguente:
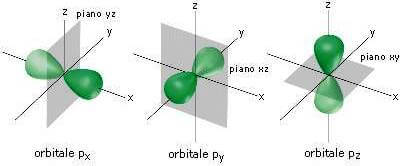
Orbitali px, py, pz
Rappresentati insieme, i tre orbitali p assumono l'aspetto come nella figura di destra:
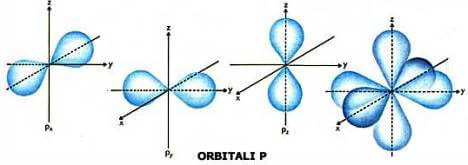
I tre orbitali di tipo p hanno uguale energia e pertanto si dice che il sottolivello di tipo p è formato da tre orbitali degeneri.
Il sottolivello p è saturo con 6 elettroni. Nel caso in cui l'orbitale è parzialmente occupato da tre elettroni, in accordo con la regola di Hund esso viene rappresentato nel seguente modo:
![]()
Orbitale p semisaturo
In accordo con il principio di esclusione di Pauli, il successivo elettrone viene collocato nel seguente modo:
![]()
Link correlati:
Qual è la differenza tra orbita e orbitale?
Studia con noi