2-butene
Formula di struttura del 2-butene
Il 2-butene, noto anche con i nomi di 2-butilene e di β-butilene, è un alchene a quattro atomi di carbonio con formula bruta C4H8 e massa molare 56,11 g/mol.
A temperatura ambiente è un gas incolore e inodore; la sua manipolazione deve essere condotta con estrema cautela in quanto è un gas estremamente infiammabile formando miscele esplosive con l'aria.
Formula di struttura del 2-butene
La formula di struttura del 2-butene è la seguente:
![]()
Formula di struttura del 2-butene.
Infatti, in base alle regole IUPAC per l'assegnazione dei nomi agli alcheni, il suffisso -ano del corrispondente alcano a catena più lunga (nel nostro caso il butano) viene sostituito con il suffisso -ene.
La posizione del doppio legame viene assegnata numerando la catena principale partendo dall'estremità che permette di dare al doppio legame il numero più basso possibile; la posizione del doppio legame è individuata dal numero del primo atomo di carbonio coinvolto nella formazione del doppio legame.
In questo caso particolare, partendo da entrambi gli atomi di carbonio posti all'estremità della catena, la posizione del doppio legame rimane la stessa.
Isomeri del 2-butene
Il 2-butene ha quattro isomeri; essi sono:
- 1-butene, del quale è un isomero di posizione;
- 2- metilpropene, del quale è un isomero di struttura;
- ciclobutano, del quale è un isomero di struttura;
- metilciclopropano, del quale è un isomero di struttura.
Isomeri cis-trans del 2-butene
Considerato che la libera rotazione intorno al doppio legame C=C è impedita e che i due metili terminali possono essere posizionati dalla stessa parte o da parti opposte rispetto al doppio legame C=C, esistono due diversi isomeri geometrici del 2-butene: se i due metili sono posizionati dalla stessa parte rispetto al doppio legame si ha l'isomero cis, se i due metili sono posizionati dalla parte opposta si ha l'isomero trans (per info: isomeria cis-trans).
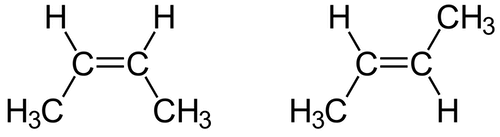
A sinistra il cis-2-butene (o cis-but-2-ene); a destra il trans-2-butene (o trans-but-2-ene).
Fornendo sufficiente energia sotto forma di luce, è possibile spezzare il legame π permettendo la libera rotazione intorno al legame σ, molto più resistente del legame π: la molecola diventa libera di ruotare attorno al legame σ e si riassesta nella forma più stabile nelle condizioni sperimentali.
Seguendo la nomenclatura E-Z e quindi le regole di Cahn, Ingold e Prelog, i due isomeri possono essere nominati anche nel seguente modo: Z-2-butene (se i due metili sono posizionati dalla stessa parte rispetto al doppio legame) e E-2-butene (se i due metili sono posizionati dalla parte opposta rispetto al doppio legame).
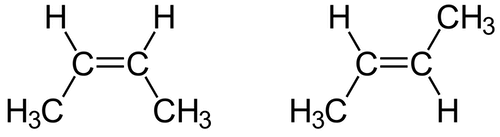
A sinistra: Z-2-butene; a destra: E-2-butene.
Stabilità dei due isomeri
Un metodo per definire la stabilità degli alcheni è quello di determinare il calore sviluppato nella reazione di idrogenazione: la differenza tra i calori di idrogenazione degli alcheni isomeri è pertanto una misura quantitativa della loro stabilità.
Per i gli isomeri cis-trans del 2-butene si hanno i seguenti valori:
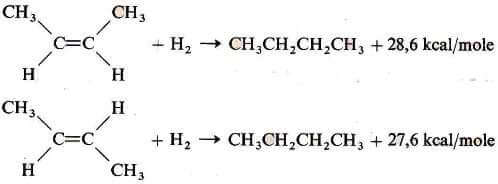
Come è possibile notare dai valori dei due calori di idrogenazione e come rappresentato nella figura seguente, il composto cis-2-butene è meno stabile (e quindi ha un contenuto di energia maggiore) del composto trans-2-butene (infatti nella reazione di idrogenazione sviluppa circa 1 Kcal/mole in più rispetto all'isomero trans).
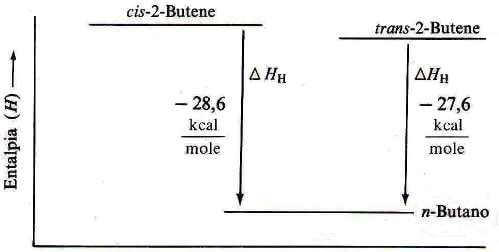
Contenuto relativo di energia del cis- e del trans-2-butene.
Separazione dei due isomeri
A causa della vicinanza dei loro punti di ebollizione (circa 4 °C per l'isomero cis e circa 1 °C per l'isomero trans), i due isomeri sono difficilmente separabili per distillazione. Ciò poco importa a livello industriale in quanto i due isomeri si comportano in maniera simile nella maggior parte delle reazioni chimiche desiderate.
Una tipica miscela industriale contiene il 70% dell'isomero cis e il 30% dell'isomero trans.
Link correlati:
Esercizi online e gratuiti sugli alcani
Regole IUPAC per la nomenclatura degli alcani
Formula di struttura del 2,3-dimetilpentano
Studia con noi