Massa molare
Definizione di massa molare
La massa molare M di un composto rappresenta la massa in grammi di una mole; essa coincide numericamente con il valore della massa molecolare (o eventualmente con la massa atomica) ma la sua unità di misura è g/mol.
Massa Molare: alcuni esempi
Consideriamo inizialmente un elemento chimico come ad esempio il sodio. Consultando qualsiasi tavola periodica è possibile sapere che la massa atomica del sodio è 23 u.
La sua massa molare è numericamente uguale alla massa atomica solo che la sua unità di misura è g/mol. la massa molare del sodio è pertanto 23 g/mol. Ciò significa che una mole di sodio ha una massa di 23 grammi.
Ricordando che una mole è la quantità di sostanza che contiene un numero di Avogadro (= 6,022 · 1023) di particelle elementari, atomi o molecole, possiamo dire che 6,022 · 1023 atomi di sodio hanno una massa di 23 grammi.
Consideriamo ora la molecola dell'acqua (H2O): la sua massa molecolare è 18 u. Infatti nella molecola dell'acqua sono presenti due atomi di idrogeno (ciascuno dei quali ha una massa atomica di 1 u) e un atomo di ossigeno (che ha una massa atomica di 16,00 u); pertanto: 16 + 1 + 1 = 18 u.
La massa molare M dell'acqua coincide numericamente alla sua massa molecolare solo che la sua unità di misura è g/mol; la massa molare dell'acqua è pertanto 18 g/mol. Questo dato ci indica che una mole di acqua ha una massa di 18 grammi.
Consideriamo ora la molecola del glucosio C6H12O6: determiniamo inizialmente la sua massa molecolare ricordando che la massa atomica del carbonio è circa 16 u, quella dell'idrogeno è circa 1 u e quella dell'ossigeno è 16 u.
Nella molecola del glucosio sono presenti 6 atomi di C, 12 di H e 6 di O, pertanto la sua massa molecolare sarà: (6 ∙ 12) + (12 ∙ 1) + (6 ∙ 16) = 180 u. La sua massa molecolare è pertanto 180 u.
La massa molare M del glucosio sarà quindi 180 g/mol; questo dato indica che una mole di glucosio ha una massa di 180 grammi.
Il discorso non cambia, come già detto, se anziché delle molecole vengono considerati degli atomi. Il ferro Fe ha una massa atomica di circa 56 u. La sua massa molare M sarà quindi 56 g/mol.
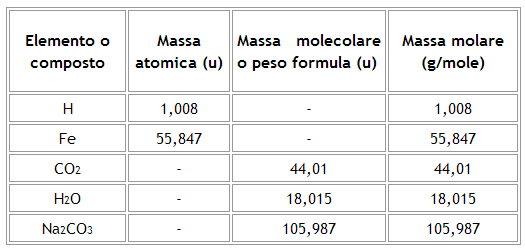
Altri esempi vengono riassunti nella seguente tabella:
Calcolo della massa molare del piombo
Il piombo Pb è un elemento chimico e pertanto è formato da singoli atomi. Consultando la tavola periodica vediamo che la massa atomica del piombo è di 207,2 u, pertanto la massa molare del piombo sarà 207,2 g/mol. Una mole di piombo (ovvero 6,022 · 1023 atomi) hanno una massa di 207,2 grammi.
Esercizio: calcolo della massa molare del benzene
Sapendo che la formula chimica del benzene è C6H6, si determini la sua massa molare.
Svolgimento
La molecola del benzene è formata da sei atomi di carbonio (ciascuno dei quali ha una massa atomica di circa 12 u) e sei atomi di idrogeno (ciascuno dei quali ha una massa atomica di circa 1 u).
La massa molare del benzene è pertanto:
M = (6 ∙ 12) + (6 ∙ 1) = 78 g/mol
Una mole di benzene ha pertanto una massa di 78 grammi.
Ti potrebbe interessare: masse molari tutti i composti - PDF.
Esercizio: calcolo della massa molare dell'acido fosforico
Sapendo che la formula chimica dell'acido fosforico è H3PO4, si determini la sua massa molare.
Svolgimento
La molecola dell'acido fosforico è formata da tre atomi di idrogeno (ciascuno dei quali ha una massa atomica di circa 1 u), un atomo di fosforo (che ha massa atomica di circa 31 u) e quattro atomi di ossigeno (ciascuno dei quali ha una massa atomica di 16 u).
La massa molare dell'acido fosforico è pertanto:
M = (3 ∙ 1) + (1 ∙ 31) + (4 ∙ 16) = 98 g/mol
Una mole di acido fosforico ha pertanto una massa di 98 grammi.

Tutti i vetrini contengono una mole di sostanza: infatti in ognuna di esse è presente una quantità in grammi pari al valore della massa molare. Tutte le sostanze contengono un numero di Avogadro di particelle (ovvero 6,022 · 1023 atomi).
Calcolo online della massa molare
Grazie al tool che ti proponiamo sarà sufficiente scrivere la formula chimica di un composto e immediatamente ti verrà restituito il valore della massa molare. Il tool lo trovi al seguente link: calcolo online della massa molare.
Esercizi sul calcolo della massa molare
Alcuni esercizi guidati e risolti li trovi al seguente link: esercizi massa molare.
Calcoli con la massa molare
Conoscendo la massa in grammi m di una sostanza è possibile determinare il numero delle moli da cui è composta attraverso la seguente relazione matematica:
![]()
in cui:
- n = numero moli (mol)
- m = massa in grammi (g)
- M = massa molare (g/mol)
Utilizzando la formula inversa, è possibile determinare il valore della massa m di un campione di un certo elemento o composto conoscendo il numero di moli n che esso contiene:
![]()
Conoscendo infine il numero di moli e la massa in grammi di una sostanza è possibile determinare il valore della massa molare con la seguente formula:
![]()
Esercizio
A quante moli corrispondono 10 grammi di acido fosforico (H3PO4)?
Svolgimento dell'esercizio
Sappiamo dall'esercizio precedente che la massa molare dell'acido fosforico è di 98 g/mol. Ricordando che:
n = m / M
si ha che:
n = 10 / 98 = 0,102 mol
Esercizi sulla mole
Se ti interessano esercizi svolti su questi argomenti vai al seguente link: esercizi con le moli.
Quiz sulla mole
Se ti interessano li trovi qui: quiz sulla mole.
Link correlati:
Tool per il calcolo online del numero di moli
Quanto vale la massa molare dell'ossigeno?
Come si calcola la massa molare dell'idrogeno?
Calcolo della massa molare conoscendo i grammi e le moli
Quanto vale la massa molare dell'azoto?
Studia con noi