Temperatura di ebollizione
Temperatura di ebollizione: definizione e spiegazione
È noto che una sostanza può presentarsi in più stati di aggregazione (solido, liquido, vapore, ecc.), ciascuno dei quali ha un ben definito campo di stabilità. L'ebollizione è il passaggio di una sostanza dallo stato liquido allo stato di vapore e la temperatura alla quale avviene è detta temperatura di ebollizione.
Per meglio comprendere quanto detto pendiamo in esame dell'acqua contenuta all'interno di un recipiente e supponiamo di riscaldarla. Inizialmente la temperatura dell'acqua inizia a crescere fino a raggiungere una temperatura alla quale l'acqua inizia a bollire, ovvero inizia a trasformarsi in vapore. La temperatura alla quale avviene tale processo è detta temperatura di ebollizione.
In base a quanto appena detto risulta quindi che l'ebollizione è il passaggio dallo stato liquido allo stato vapore dell'acqua o più in generale di un corpo con formazione di vapore non soltanto alla superficie del liquido, ma in tutta la massa. Per ottenere l'ebollizione di una sostanza occorre somministrare calore dall'esterno.
Come si vedrà più avanti, durante l'ebollizione dell'acqua (o di qualsiasi altra sostanza, come ad esempio l'alcol etilico) la temperatura rimane costante; il calore somministrato nel periodo dell'ebollizione si chiama calore latente di ebollizione.
Quindi ricorda che: la temperatura di ebollizione è la temperatura alla quale avviene l'ebollizione di una sostanza; tale temperatura permane per tutto il tempo in cui si ha il passaggio del liquido a vapore.
Influenza della pressione sulla temperatura di ebollizione
In alta montagna, dove la pressione è minore che al livello del mare (pressione atmosferica), l'acqua bolle a una temperatura inferiore ai 100°C (100°C è la temperatura di ebollizione dell'acqua alla pressione atmosferica). Nella pentola a pressione, in cui la pressione è maggiore della pressione atmosferica, l'acqua bolle a una temperatura superiore a 100°C.
Un liquido può quindi bollire ad innumerevoli temperature perché innumerevoli sono i valori che la pressione esterna può assumere. Quando si parla di temperatura di ebollizione di un liquido senza fare riferimento alla pressione, si intende, convenzionalmente, che la pressione esterna è P = 1 atm.
Ma perché la pressione esterna influenza la temperatura di ebollizione?
Per rispondere alla domanda introduciamo una grandezza fisica nota come pressione di vapore.
La pressione gassosa (esercitata dal vapore acque sul suo liquido) corrispondente all'equilibrio acqua-vapore acqueo alla temperatura t, viene indicata come tensione di vapore (o pressione di vapore) dell'acqua; il suo valore è costante a temperatura costante.
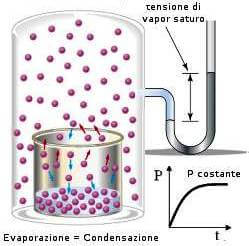
Raggiunto l'equilibrio liquido/vapore, ad una certa temperatura t, il vapore acqueo esercita sul suo liquido una pressione nota come pressione di vapore.
Aumentando la temperatura dell'acqua (o di un qualsiasi altro liquido) la sua pressione di vapore aumenta. Quando il valore della pressione di vapore raggiunge il valore della pressione che spinge sulla superficie del liquido stesso (ovvero la pressione esterna) il liquido inizia a bollire, cioè si ha la formazione di vapore non soltanto alla superficie del liquido, ma in tutta la massa.
La temperatura a cui ciò si verifica è detta temperatura di ebollizione, ed il suo valore, per uno stesso liquido, dipende ovviamente dalla pressione esterna. Quindi la temperatura di ebollizione di un liquido è quella temperatura alla quale la tensione di vapore del liquido diviene uguale alla pressione atmosferica.
Questa definizione spiega il perché la temperatura di ebollizione di un liquido varia con il variare della pressione.
Temperatura di ebollizione e curva di riscaldamento di una sostanza pura
Prendiamo in esame i fenomeni che si verificano durante il progressivo riscaldamento di un liquido come ad esempio l'acqua.
Dell'acqua viene posto in una adatta apparecchiatura che gli fornisce assai lentamente quantità note di calore e che ne registra la sua temperatura. Si immagini di operare alla pressione atmosferica e di riportare su un diagramma le temperature dell'acqua in funzione dei successivi tempi di riscaldamento; si ottiene un diagramma come quello illustrato nella figura seguente.
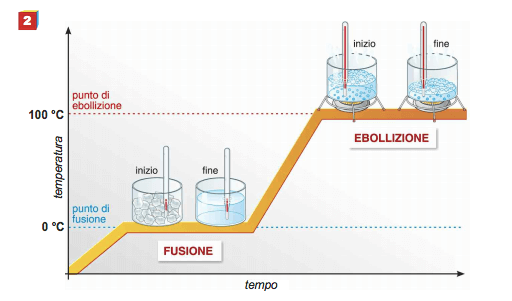
Curva di riscaldamento dell'acqua distillata: si nota che durante l'ebollizione la temperatura rimane costante a 100°C (alla pressione di 1 atm). Tale temperatura è detta temperatura (o punto) di ebollizione.
Partendo dal punto di fusione, il calore fornito al liquido fa aumentare la temperatura di questo sino a 100°C, temperatura alla quale inizia l'ebollizione dell'acqua.
Alla temperatura di 100°C (e alla pressione di 1 atm) infatti, corrisponde un'energia cinetica media delle particelle del liquido tale che la pressione di vapore del liquido raggiunge il valore della pressione esterna e il liquido inizia a bollire.
Continuando a fornire calore prosegue l'ebollizione, si mantiene costante la temperatura ed evapora sempre nuovo liquido. In corrispondenza dell'ultimo tratto della curva, tutto il liquido è evaporato.
Poiché la quantità di calore fornita al liquido nel passaggio di stato liquido → vapore non provoca aumento della temperatura del liquido, ad essa è attribuito l'aggettivo latente. Si parla così di calore latente di ebollizione, che, se riferito ad una mole di liquido che passa allo stato di vapore, prende il nome di calore latente molare di ebollizione.
Temperatura di ebollizione di alcune sostanze
Riportiamo i valori delle temperature di ebollizione di alcune sostanze determinate alla pressione di 1 atm.
Temperatura di ebollizione dell'azoto (-196°C)
Temperatura di ebollizione dell'ossigeno (-183°C)
Temperatura di ebollizione dell'alcol etilico (78,5°C)
Temperatura di ebollizione dell'acqua (100°C)
Temperatura di ebollizione del mercurio (356,7°C)
Temperatura di ebollizione dell' sale da cucina (1465°C)
Temperatura di ebollizione dell'alluminio (2327°C)
Temperatura di ebollizione dell'oro (2808°C)
Link correlati:
Quanto vale il calore latente dell'acqua?
Che cos'è la curva di raffreddamento di una sostanza pura?
Studia con noi