Iprite
Proprietà e caratteristiche dell'iprite
L'iprite, nota anche con il nome di diclorodietilsolfuro è un composto chimico di formula bruta C4H8Cl2S.
È un solfuro ß,ß'-dicloroetilico che presenta la seguente struttura:
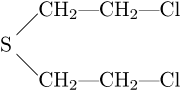
Ha massa molare di 159 g/mol, temperatura di fusione di 14,4°C, temperatura di ebollizione di 217,5°C e densità di 1,27 g/cm3.
Si presenta come un liquido alto-bollente di colore bruno-giallognolo, irritante e vescicante, che rimane a lungo sul terreno. Non è solubile in acqua e pertanto non viene dilavato dalla pioggia.
Venne impiegato come aggressivo chimico nella prima guerra mondiale nella città belga di Ypres (da cui prende il nome) nel luglio del 1917.
Ha il caratteristico odore di senape e per tale motivo viene detto anche "gas mostarda".
Bonifica da contaminazione da iprite
Per la bonifica di terreni contaminati da iprite si impiega cloruro di calcio miscelato con terra o sabbia.
Per la bonifica di indumenti e oggetti vari possono essere impiegate sia soluzioni ossidanti (permanganato di potassio, ipoclorito di sodio) che solventi organici (benzina, tetracloruro di carbonio).
Infine, per la bonifica umana possono essere impiegate soluzioni di cloro in tetracloruro di carbonio o, più in generale, pomate o polveri contenenti sostanze capaci di cedere cloro.
Sintesi dell'iprite
La preparazione industriale dell'iprite prevede l'iniziale sintesi della cloridrina del glicole etilenico (ClCH2CH2OH) ottenuta per reazione dell'etilene con acido ipocloroso:
CH2=CH2 + HClO → ClCH2CH2OH
Quest'ultima, trattata con solfuro di sodio (Na2S) porta alla formazione del tiodiglicol S(CH2CH2OH)2 dal quale, infine, si ottiene l'iprite per clorurazione.
Link correlati:
Che cos'è il creosoto?
Studia con noi