Ipoclorito di sodio
Proprietà e caratteristiche dell'ipoclorito di sodio
L'ipoclorto di sodio è un sale ternario con formula chimica NaClO.
Grandi quantità di ipoclorito di sodio vengono usate nel commercio e nell'industria.
Una soluzione acquosa ottenuta aggiungendo 155 g di di ipoclorito di sodio in 1 L di acqua pura ha circa pH = 12.
Ciò è dovuto all'idrolisi basica dello ione ipoclorito ClO−.
NaClO → Na+ + ClO−
ClO− + H2O ⇄ HClO + OH−
Preparazione della soluzione di ipoclorito di sodio
Una soluzione di ipoclorito di sodio si può ottenere insufflando cloro in una liscivia di soda:
Na2CO3 + Cl2 + H2O → NaCl + NaHCO3 + HClO
Se si fa reagire sulla soda una quantità doppia di cloro:
Na2CO3 + 2 Cl2 + H2O → 2 NaCl + CO2 + 2 HClO
si ottengono ottimi candeggianti, che però non possono essere trasportati e debbono essere usati sul posto.
Più stabili risultano le soluzioni ottenute impiegando una liscivia contenente carbonato ed idrossido di sodio, perché in queste condizioni il cloro attivo si trova sotto forma di ipoclorito di sodio anziché di acido ipocloroso:
Na2CO3 + NaOH + Cl2 → NaCl + NaHCO3 + NaClO
È possibile ottenere soluzioni di ipoclorito di sodio anche tramite elettrolisi di soluzioni acquose di cloruri alcalini.
Il cloro che si separa all'anodo reagendo con gli ioni OH− che si formano al catodo dà acido ipocloroso, che si combina con altri ioni OH− neutralizzandosi ad ipoclorito:
Cl2 + 2 OH− → Cl− + ClO− + H2O
È possibile preparare la soluzione di ipoclorito di sodio anche per reazione di doppio scambio tra cloruro di calce (CaOCl2) in soluzione e carbonato, solfato o idrossido di sodio:
CaOCl2 + Na2CO3 → NaClO + NaCl + CaCO3
CaOCl2 + Na2SO4 → NaClO + NaCl + CaSO4
CaOCl2 + 2 NaOH → NaClO + NaCl + Ca(OH)2
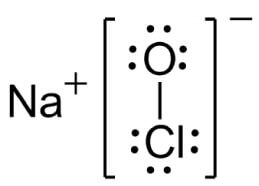
Struttura dell'ipoclorito di sodio
Usi dell'ipoclorito di sodio
I candeggianti clorurati vengono usati nell'industria della carta e dei tessuti; inoltre in lavanderia.
Le proprietà sbiancanti e l'azione sterilizzante dell' ipoclorito di sodio è connessa con la reazione:
NaClO + 2 H+ + 2e− → NaCl + H2O
nella quale l'ipoclorito si comporta da ossidante.
Soluzioni diluite di ipoclorito di sodio contenenti anche carbonato e solfato di sodio con l'1% di "cloro attivo" vengono usate come acque da bucato, ad esempio, la candeggina.
L'azione sbiancante delle soluzioni alcaline è molto piccola. Essa aumenta con l'aumentare dell'acidità della soluzione. Contemporaneamente, però, le fibre vengono anche più fortemente attaccate; la velocità di sbianca aumenta anche col crescere della temperatura.
Le lavanderie usano soluzioni all'1,3% come additivo ai detersivi, per ottenere un bucato più bianco.
Soluzioni con un contenuto di ipoclorito sodico non inferiore al 4% e non superiore al 6% hanno sostituito come mezzo disinfettante le soluzioni più diluite impiegate in passato nella pratica medica.
L'ipoclorito di sodio viene usato anche per sterilizzare l'acqua potabile.
Una soluzione solida di ipoclorito sodico in fosfato trisodico dodecaidrato, contenente il 3,5-5% di "cloro attivo", è stata in commercio per molti anni sotto il nome di "diversol". Questo prodotto ha una buona stabilità.
Precauzioni nell'uso dell'ipoclorito di sodio
Al riguardo si veda: candeggina.
Link correlati:
Tabella diluizione ipoclorito di sodio
Studia con noi