Apoproteine
Cosa sono le apoproteine?
Per apoproteina si intende la parte proteica di una proteina che per svolgere la sua funzione necessita di un gruppo prostetico non proteico.
Sono apoproteine, ad esempio le globine della mioglobina e dell'emoglobina (vedi di seguito).
In conseguenza di quanto appena detto, il gruppo prostetico è una porzione di una proteina necessaria per lo svolgimento della funzione proteica ma chimicamente diverso dagli amminoacidi (ad esempio il gruppo eme dell'emoglobina).
In maniera similare si parla di gruppo prostetico, oppure di coenzima, di un enzima (ad esempio: centro ferro-zolfo, vitamina, ecc), per la porzione non proteica necessaria allo svolgimento dell'attività enzimatica e di apoenzima per la porzione proteica.
Mioglobina e emoglobina
Un esempio di apoproteina è dato dalle globine presenti rispettivamente nella mioglobina e nell'emoglobina nelle quali in gruppo prostetico è costituito dal gruppo eme, contenente ferro.
Si tratta di proteine di trasporto dell'ossigeno. L'emoglobina trasporta l'ossigeno dai polmoni ai tessuti periferici, la mioglobina funge da deposito di ossigeno nel tessuto muscolare.
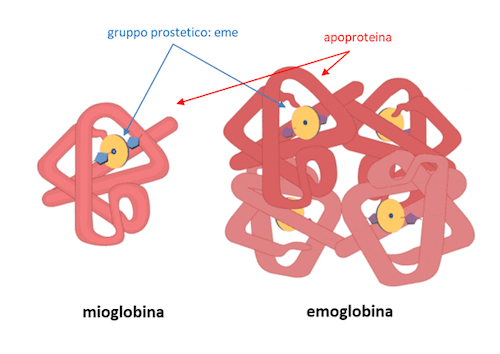
La mioglobina e l'emoglobina rappresentano un esempio di proteina costituita da apoproteina e gruppo prostetico.
Il legame tra ossigeno e proteina avviene grazie al gruppo prostetico, ovvero all'eme. Quest'ultimo, legato alla proteina in una tasca idrofobica, è costituito da una componente organica e da un atomo di ferro (Fe2+) posizionato al centro. La porzione organica è costituita da quattro anelli pirrolici legati a formare un tetrapirrolo ciclico, detto protoporfirina.
L'atomo di ferro si dispone al centro della protoporfirina, legato ai quattro atomi di azoto dei quattro anelli pirrolici e si trova in stato di ossidazione II. Oltre a tali legami, lo ione ferro (Fe+2), può formare altri due legami, detti di coordinazione.
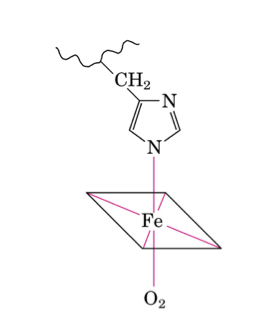
Residuo amminoacidico (istidina) del quinto legame di coordinazione con lo ione Fe2+.
Nella deossiemoglobina (scarica di ossigeno) il quinto legame avviene con un residuo amminoacidico, in particolare con un'istidina, detta istidina prossimale, mentre il sesto sito di coordinazione non è impegnato ed è, dunque, disponibile per l'ossigeno.
Il legame dell'ossigeno provoca un cambiamento conformazionale, lo ione ferro che subisce un arrangiamento elettronico, cambia posizione, nell'emoglobina scarica di ossigeno si trova all'esterno del piano della protoporfirina, quando si lega l'ossigeno si viene a trovare sullo stesso piano.
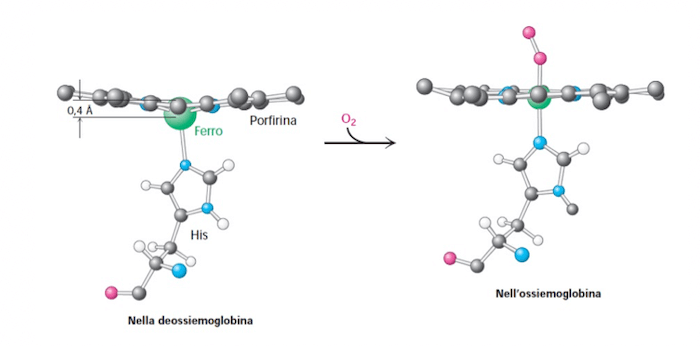
Cambiamento di conformazione dello ione ferro rispetto al piano della protoporfirina.
Per quanto concerne la porzione proteica, la mioglobina è costituita da un'unica subunità, detta globina, mentre l'emoglobina presenta quella che prende il nome di struttura quaternaria delle proteine ed è costituita da quattro globine (denominate alpha e beta, nello specifico due alpha e due beta) legate da legami secondari (non covalenti). Nella mioglobina troviamo un solo gruppo eme, mentre nell'emoglobina ne troviamo quattro.
Dal punto di vista generale, la mioglobina e l'emoglobina presentano diversa affinità per l'ossigeno, alta per la prima, bassa per la seconda e ciò in relazione alla diversa funzione: la mioglobina funge da deposito di ossigeno mentre l'emoglobina deve essere in grado di legare l'ossigeno nei polmoni, dove la sua quantità è elevata (per i gas si parla di pressione e non di concentrazione) e di rilasciarlo nei tessuti, dove la pressione parziale dell'ossigeno è notevolmente più bassa.
Le quattro subunità dell'emoglobina legano l'ossigeno in maniera cooperativa ed allosterica, ovvero, senza voler addentrarci nei particolari del funzionamento biologico di questa proteina trasportatrice, l'affinità per l'ossigeno aumenta all'aumentare del numero di atomi legati.
In questo modo in circolo troveremo sempre molecole di emoglobina completamente cariche di ossigeno (non molecole contenenti ad esempio solo un atomo o solo due, ecc) in grado di trasportarlo efficientemente nei tessuti periferici.
Il legame dell'ossigeno provoca dei cambiamenti conformazionali responsabili dell'aumento dell'affinità, ovvero del passaggio dalla forma tesa, T, della desossiemoglobina a quella rilassata, R, dell'ossiemoglobina. In particolare si assiste allo scivolamento di un dimero alpha/beta sull'altro che porta al restringimento della tasca presente tra le subunità beta.
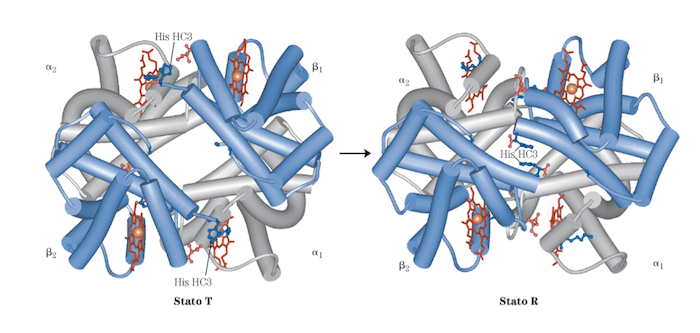
Cambiamento conformazionale nell'emoglobina a seguito del legame cooperativo dell'ossigeno nelle quattro subunità globiniche.
Apotransferrina
La proteina apotransferrina incorpora atomi di ferro, generando dunque la transferrina: proteina di trasporto del ferro. Il ferro nelle cellule e nei fluidi del nostro corpo non è mai libero, è sempre legato a specifiche proteine di deposito, la ferritina e la emosiderina e a proteine di trasporto, la transferrina, appunto, e la lattoferrina.
Dall'alimentazione il ferro è assorbito, in proporzione al fabbisogno, nel duodeno e si accumula nel fegato. Dal fegato il ferro viene successivamente liberato, sulla base del fabbisogno dell'organismo, nel circolo ematico. Qui si lega alla transferrina ed alla lattoferrina così da raggiungere i tessuti periferici.
La lattoferrina è una glicoproteina della famiglia della transferrina, così chiamata poiché si trova principalmente nel latte anche se è presente in diverse secrezioni, quali le lacrime e la saliva.
La transferrina, come accennato, prima di legare il ferro, si trova come apoproteina (apotransferrina) la quale subisce un cambiamento conformazionale dopo che avviene il legame con il ferro.
La transferrina trasporta dunque il ferro nell'organismo, mediante il circolo sanguigno, fino agli organi quali, in particolare, fegato, milza e midollo osseo. Il rilascio del ferro ai tessuti avviene tramite una specifica famiglia recettoriale dei recettori della transferrina (TfR). Tali recettori sono ubiquitinariamente espressi sulla membrana delle nostre cellule in funzione del fabbisogno di ferro.
Il complesso che si forma in membrana tra recettore, transferrina e ferro, ne causa l'internalizzazione tramite la formazione dell'endosoma.
L'endosoma all'interno della cellula si fonde con vescicole dal pH acido, il cambiamento del pH porta provoca il rilascio del ferro dalla transferrina. Il recettore della transferrina non subisce invece mutamenti. Il ferro viene trasportato attraverso la membrana endosomiale all'interno della cellula, si lega a una proteina carrier che lo conduce ai mitocondri per la sintesi dell'eme, oppure viene immagazzinato grazie alla ferritina.
La transferrina, invece, viene reimmessa nel circolo sanguigno sotto forma di apotransferrina non legata al suo recettore, pronta per ripetere il ciclo.
Il ferro dunque circola nel sangue finché non si ha il legame con un recettore di membrana per la transferrina su una cellula, la quantità di transferrina nel sangue è dunque indice della quantità di ferro presente nell'organismo.
In carenza di ferro, il fegato produce maggiori quantità di transferrina per consentirne il trasporto alle cellule. Viceversa, la transferrina diminuisce quando aumentano i livelli di ferro.
Apolipoproteine
Le apolipoproteine sono costituenti delle lipoproteine di trasporto dei lipidi nel sangue, in particolare si distinguono: AI, AII, B, C ed E. Tali proteine sono differenti per peso molecolare ed origine anche se per lo più sono prodotte a livello epatico.
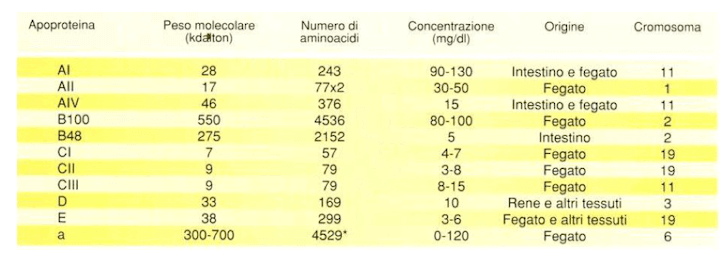
Principali caratteristiche delle apoproteine presenti nelle lipoproteine.
Per quanto concerne le funzioni delle diverse apoproteine:
AI è attivatore dell'L-CAT ovvero la lecitin-colesterolo transferrasi oltre ad essere una proteina di struttura delle HDL.
La AII è anch'essa di struttura delle HDL ed è in grado di legare i fosfolipidi.
La AIV gioca un ruolo negli scambi lipidici della fase postprandiale.
La B100 ha un ruolo nella sintesi intracellulare delle VLDL e nel loro trasporto transcellulare. Inoltre B100 è implicata nell'interazione delle LDL con le cellule a mezzo dei recettori per Apo-B ed E.
B48 svolge un ruolo nella sintesi intracellualre e nel trasporto transcellualre dei chilomicroni.
CI è anch'esso attivatore dell'enzima L-CAT.
CII è cofattore delle LPL (lipolipasi lipoproteica) tissutali, mentre CIII sembra esserne un inibitore.
La apoproteina D è un altro attivatore delle L-CAT mentre la E svolge un ruolo nell'interazione delle lipoproteine con le cellule tramite recettori specifici, in particolare nelle cellule epatiche.
Apoproteina F svolge ruolo di struttura minore nelle lipoproteine e negli scambi dei lipidi.
Infine, la apoproteina H svolge un ruolo di attivazione nei confronti di L-CAT.
Inoltre, Apo-A è una glicoproteina ad alto peso molecolare prodotta dal fegato con struttura omologa a quella del plasminogeno. Dal punto di vista funzionale Apo-A è in grado di associarsi, mediante la formazione di un ponte di solfuro (legame di tipo covalente possibile tra due residui di cisteina presenti nella struttura proteica) a formare la lipoproteina denominata Lp(a).
Link correlati:
In botanica che cosa è l'appassimento?
Che cos'è il nucleocapside?
Studia con noi