Gruppo prostetico
Che cosa è un gruppo prostetico?
Un gruppo prostetico è una molecola di natura non proteica strettamente legata a una proteina, in genere un enzima.
I gruppi prostetici appartengono alla classe dei cofattori, i quali sono molecole che permettono agli enzimi di eseguire le proprie funzioni.
I cofattori possono essere ioni oppure molecole organiche. I cofattori costituiti da molecole organiche sono definiti coenzimi.
I coenzimi, a loro volta, si dividono in cosubstrati e gruppi prostetici, in base alla modalità con cui interagiscono con gli enzimi.
I gruppi prostetici si legano all'enzima in maniera stabile, per mezzo di legami covalenti oppure di coordinazione, al contrario dei cosubstrati che vi si legano in maniera transitoria.
Quindi, i gruppi prostetici restano legati agli enzimi in maniera permanente e non se ne distaccano neppure nel caso in cui l'enzima non debba svolgere la propria attività catalitica, mentre i cosubstrati si legano solamente al momento della catalisi.
L'enzima, in assenza del gruppo prostetico, non può svolgere le sue funzioni e prende il nome di apoenzima o apoproteina.
Con il legame tra gruppo prostetico ed enzima, si forma la proteina funzionale, che viene chiamata oloenzima.
Reazioni dei gruppi prostetici
I gruppi prostetici partecipano a numerose reazioni biochimiche e, in particolare, sono coinvolte in:
- Reazioni di ossidoriduzione:
- Trasferimento di elettroni.
- Trasferimento di protoni.
- Reazioni di trasferimento di gruppi chimici:
- Transamminazione (trasferimento di gruppi amminici).
- Carbossilazione (aggiunta di una molecola di anidride carbonica).
- Decarbossilazione (perdita di una molecola di anidride carbonica).
- Transacilazione (trasferimento di gruppi acile).
- Trasferimento di gruppi metile.
- Trasferimento di gruppi fosfato.
- Isomerizzazioni.
Esempi di gruppi prostetici
I gruppi prostetici più comuni sono:
1) Eme (o ematina).
Questa molecola ha una struttura ad anello, la protoporfirina, legata a un atomo di ferro, nello stato di ossidazione +2.
Più precisamente essa presenta 4 anelli pirrolici legati per mezzo di ponti metinici.
L'atomo di ferro lega i 4 atomi di azoto pirrolici e forma altri 2 legami.
L'eme entra nella costituzione di emoglobina e mioglobina (che non sono propriamente degli enzimi), le proteine deputate al trasporto e al rilascio di ossigeno nell'organismo, ed è un costituente dei citocromi, che sono enzimi con la funzione di trasportare elettroni, coinvolti nella produzione di energia (sono i costituenti della catena di trasporto elettronica) e nel metabolismo dei farmaci.
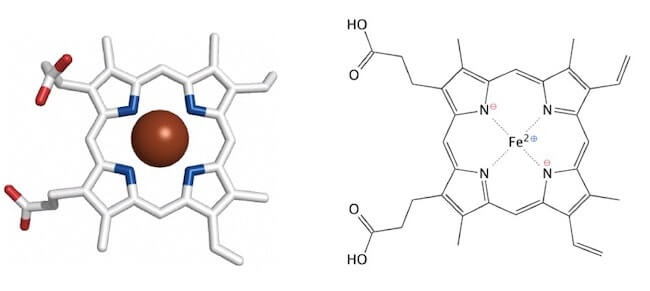
Struttura dell'eme.
2) FAD (flavina adenina dinucleotide)
Questa molecola è formata dal gruppo isoallosazinico (i 3 anelli condensati), il quale è legato al ribitolo, che, a sua volta, è collegato, per mezzo di due gruppi fosfato all'adenina (una base purinica).
La sua forma ossidata è chiamata FAD, quella ridotta FADH2.
Il FAD è coinvolto in reazioni ossidoriduttive, in cui si verifica il trasferimento di 1 o 2 elettroni.
In particolare, esso entra, come i citocromi, nel processo della catena di trasporto di elettroni.
Inoltre, è coinvolto nel ciclo di Krebs, dove contribuisce all'ossidazione dei substrati.
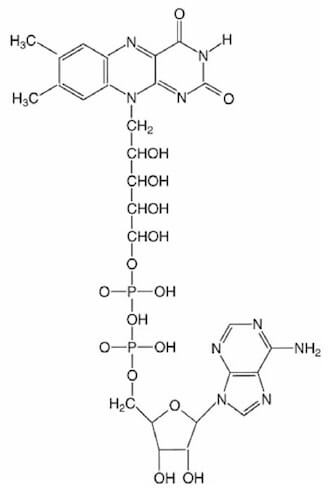
Struttura del FAD.
3) Biotina
La biotina è costituita da 2 anelli condensati: l'anello imidazolidinonico e l'anello tiofenico, legato all'acido valerianico.
La biotina è coinvolta in diverse reazioni biochimiche fondamentali per la sintesi dei glucidi e dei lipidi.
In particolare, interviene nelle reazioni di carbossilazione catalizzate dagli enzimi della classe delle carbossilasi, a cui si lega per mezzo di un legame peptidico.
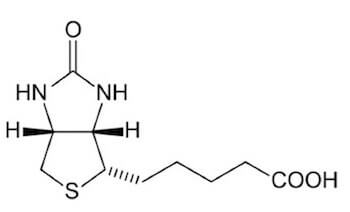
Struttura della biotina.
Studia con noi