Enzimi
Che cosa sono gli enzimi?
Gli enzimi sono catalizzatori biologici di natura proteica, senza i quali la vita non potrebbe esistere.
Solo un piccolo gruppo di enzimi è costituito di molecole di RNA, detti ribozimi, che entrano in gioco in alcuni processi come la sintesi proteica e lo splicing dell'RNA messaggero nelle cellule eucariotiche.
Gli enzimi presiedono alle innumerevoli reazioni metaboliche di un organismo vivente, regolando gli scambi di energia con l'ambiente esterno.
Grazie agli enzimi, è possibile digerire gli alimenti, recuperare l'energia nei legami delle biomolecole sotto forma di ATP, utilizzabile per tutti i processi endoergonici, anch'essi catalizzati da enzimi, come la biosintesi di macromolecole da sostanze organiche più semplici, il movimento, il trasporto di membrana contro gradiente ed altro ancora.
Gli enzimi riescono ad accelerare le reazioni di un fattore tra 105 e 107, mostrando un potere catalitico e una specificità spesso di gran lunga superiore rispetto ai catalizzatori inorganici e di sintesi.
Il ruolo centrale svolto dagli enzimi per la sopravvivenza degli organismi viventi spiega come mai molte malattie genetiche che alterano la funzionalità di molti enzimi diano luogo a condizioni patologiche anche piuttosto gravi.
La valutazione del quantitativo di certi enzimi nel sangue e in altri tessuti è un utile strumento diagnostico in caso, ad esempio, di disfunzioni epatiche e cardiache.
L'azione di molti farmaci, inoltre, si basa sull'interazione con enzimi, modulandone in vario modo l'attività.
Nomenclatura degli enzimi
Il nome degli enzimi deriva dal substrato o da una parola o una frase che ne descrive l'attività, aggiungendo il suffisso -asi.
In alcuni casi i nomi degli enzimi sono quelli dati dagli scopritori in base a una data funzione, prima che venisse scoperta la specifica reazione catalizzata, come per gli enzimi digestivi pepsina e tripsina o il lisozima.
Spesso molti enzimi sono indicati con più nomi, potendo creare confusione.
Per ovviare alle possibili ambiguità, il sistema internazionale di nomenclatura e classificazione degli enzimi prevede sei classi, a loro volta suddivise in sottoclassi.
In base a questo sistema ufficiale, ogni enzima è indicato da un nome sistematico che descrive la reazione catalizzata e da una serie di quattro numeri, il primo dei quali indica la classe, il secondo la sottoclasse.

Le sei classi di enzimi in cui sono classificati gli enzimi dal sistema internazionale.
La struttura degli enzimi
Gli enzimi sono proteine di grandi dimensioni, spesso a struttura quaternaria, in grado di legare in modo specifico una o più sostanze reagenti, dette substrati, catalizzandone la conversione in altre.
In alcuni casi gli enzimi effettuano la catalisi autonomamente, in altri richiedono l'intervento di cofattori, componenti addizionali di natura non proteica.
I cofattori possono essere ioni metallici, come Fe2+, Mg2+, Mn2+ o Zn2+, oppure complesse molecole organiche chiamate coenzimi, come NAD, FAD, biotina, coenzima A e tanti altri.
Se gli ioni metallici o un coenzima si trovano stabilmente legati agli enzimi in modo covalente sono detti gruppi prostetici.
L'insieme di componente proteica e cofattori di un enzima è detto oloenzima. La sola parte proteica è detta apoenzima o apoproteina.
Il legame dei substrati agli enzimi
Il legame dei substrati avviene in tasche degli enzimi dette siti attivi, dove i residui amminoacidici presenti assicurano la specificità del legame con i substrati e i meccanismi di catalisi necessari a far avvenire la reazione. La specificità è soprattutto assicurata da interazioni deboli.
L'interazione tra il substrato e il sito attivo è stata classicamente descritta con il modello chiave-serratura, proposto da Fisher nel 1894.
Tuttavia, se il sito attivo si adattasse perfettamente al substrato, da un punto di vista energetico la trasformazione in un composto differente non sarebbe più vantaggiosa, perché comprometterebbe la stabilità dell'interazione enzima-substrato.
Secondo il modello dell'adattamento indotto, proposto da Koshland nel 1958 e attualmente maggiormente accreditato, la specificità di legame non si realizza con il substrato ma con quello che viene definito stato di transizione, lo stato della molecola che ha subito alcune prime modifiche e si trova in una condizione intermedia tra il substrato iniziale e il prodotto finale.
Inoltre, nel garantire un'interazione quanto più ottimale possibile per la catalisi, anche il sito attivo si modifica leggermente, grazie a un cambiamento conformazionale dell'enzima.
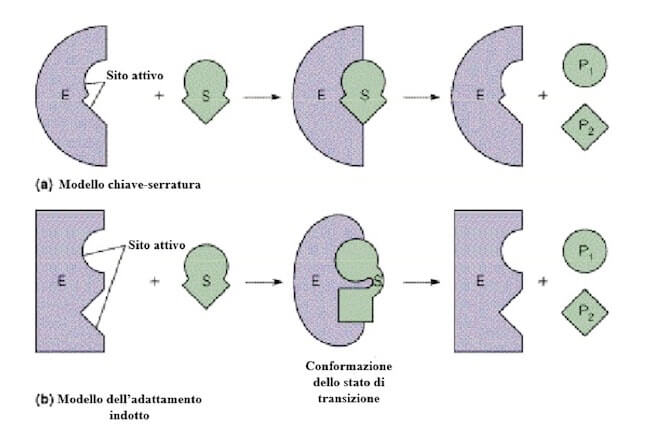
In questa immagine viene mostrata la scissione, catalizzata da un enzima, di un substrato (S) in due prodotti (P1 e P2). Secondo il modello chiave-serratura si realizza un incastro perfetto tra il substrato e il sito attivo. Nel modello dell'adattamento indotto è previsto che il legame del substrato induca un cambiamento conformazionale dell'enzima, che in questo modo realizza un'interazione più ottimale con lo stato di transizione, più favorevole alla formazione dei prodotti.
L'azione catalitica degli enzimi
In quanto catalizzatori, gli enzimi intervengono nelle reazioni, senza essere consumati, abbassandone l'energia di attivazione, spesso notevolmente alta considerando che la maggior parte delle biomolecole sono stabili nell'ambiente cellulare e la conversione in altri composti sarebbe non spontanea o addirittura improbabile.
L'energia di attivazione è una barriera energetica tra reagenti e prodotti che impedisce alla reazione di procedere in un arco di tempo compatibile con le esigenze e la sopravvivenza della cellula e di un organismo vivente.
Un enzima è in grado di abbassare l'energia di attivazione creando un ambiente favorevole che renda la reazione energeticamente favorita e realizzabile in un arco di tempo brevissimo, dell'ordine dei millesecondi.
I meccanismi con cui l'enzima favorisce l'abbassamento dell'energia di attivazione sono fondamentalmente tre.
Il primo consiste nella riduzione dei movimenti casuali delle molecole reagenti che vengono immobilizzati sulla superficie dell'enzima per favorirne l'orientamento corretto ai fini della reazione.
Secondariamente, l'interazione con l'enzima sottrae il substrato all'alone di solvatazione realizzato dalle molecole di acqua che, grazie ai legami a idrogeno, stabilizza gran parte delle molecole biologiche nelle cellule.
In terzo luogo, l'enzima adotta meccanismi di catalisi che rendono energeticamente possibili la rottura e la formazione dei legami chimici, processi necessari nel corso di una reazione per generare nuove sostanze da uno o più reagenti inziali.
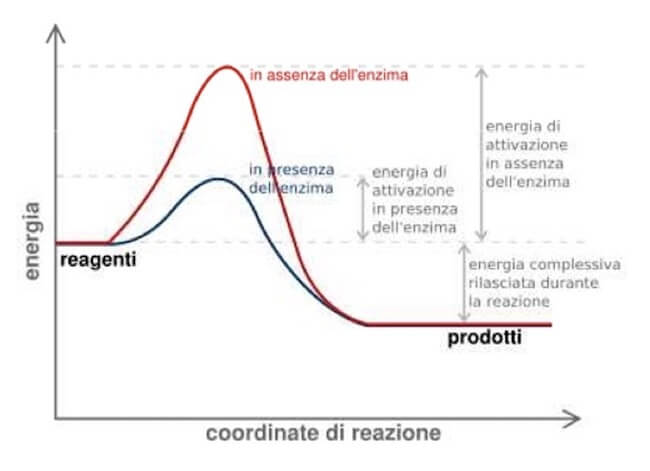
Grafico che mostra il contributo di un enzima a una reazione. Nelle cellule, le biomolecole non reagiscono spontaneamente perché stabili e le reazioni a cui andrebbero incontro hanno un'energia di attivazione così alta da renderle quasi improbabili. Gli enzimi rendono possibili le reazioni in ambito biologico, facendole avvenire in un arco di tempo brevissimo, dell'ordine dei millesecondi, perché abbassano l'energia di attivazione. Si noti dal grafico come l'equilibrio della reazione (indicato dalla variazione di energia libera) non viene comunque alterato dall'enzima.
I meccanismi di catalisi
I meccanismi di catalisi sono le strategie messe in atto dagli enzimi nei processi di rottura e formazione dei legami che avvengono nel corso della reazione.
Tra i meccanismi meglio caratterizzati vi sono:
- la catalisi acido-base;
- la catalisi covalente;
- la catalisi da ioni metallici.
La catalisi acido-base consiste nel trasferimento di H+ dai residui amminoacidici del sito attivo dell'enzima o viceversa creando intermedi la cui trasformazione nei prodotti avviene più facilmente.
La catalisi covalente presuppone la formazione di un legame covalente transitorio tra il substrato e la componente proteica dell'enzima o un suo coenzima.
Alcuni enzimi possiedono come cofattore ioni metallici, le cui cariche positive hanno in genere la funzione di orientare il substrato e stabilizzarne le eventuali cariche.
La cinetica enzimatica
La maggior parte degli enzimi mostra una relazione iperbolica tra la concentrazione di substrato e la velocità della reazione catalizzata, descritta matematicamente dall'equazione di Michaelis-Menten.
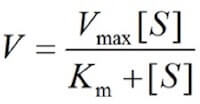
Data una certa quantità di enzima, la velocità della reazione aumenta in modo quasi direttamente proporzionale rispetto alla concentrazione del substrato in una prima fase, per poi raggiungere un valore massimo (Vmax), che viene mantenuto nonostante si continui ad aggiungere substrato.
Il raggiungimento della velocità massima è dovuto alla saturazione dei siti attivi delle molecole degli enzimi. Solo aumentando la quantità di enzima è possibile ottenere un ulteriore aumento della velocità, destinata anche in questo caso a raggiungere un valore massimo quando non ci saranno più siti attivi disponibili per legare le molecole di substrato.
Nell'equazione di Michaelis-Menten figura la costante Km (costante di Michaelis), specifica per ogni reazione catalizzata.
Essa rappresenta la concentrazione di substrato alla quale si raggiunge metà della velocità massima e può essere considerata una misura dell'affinità dell'enzima per il substrato.
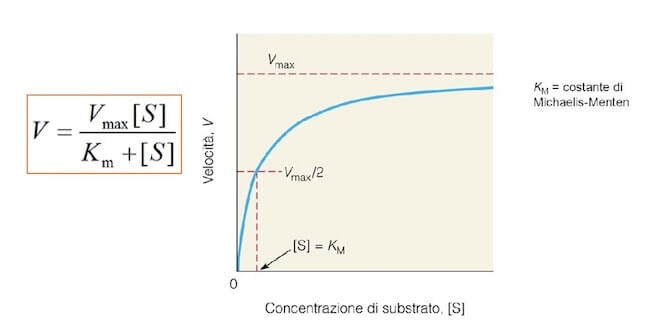
Per la maggior parte degli enzimi la velocità della reazione dipende in modo iperbolico dalla concentrazione del substrato, come l'equazione di Michaelis-Menten e il relativo grafico mostrano.
La regolazione dell'attività enzimatica
L'attività di un enzima deve essere regolata in modo fine per garantire l'adattamento alle richieste della cellula e assicurare che la reazione si realizzi solo nel luogo e nel tempo in cui occorre.
Soprattutto gli enzimi del metabolismo energetico subiscono una regolazione coordinata e continua per impedire sprechi di energia e ottimizzare gli scambi energetici tra i processi endoergonici ed esoergonici che la cellula mette continuamente in atto.
La regolazione dell'attività enzimatica può essere realizzata mediante modificazioni allosteriche, modificazioni covalenti o tagli proteolitici.
La regolazione allosterica si basa sul cambiamento conformazionale dell'enzima: cambiamenti anche minimi nell'arrangiamento dei residui amminoacidici nella struttura tridimensionale della proteina possono influenzare notevolmente la velocità della reazione, aumentandola o diminuendola. I cambiamenti conformazionali sono indotti da piccole molecole, dette modulatori allosterici, che generalmente si legano in siti diversi dal sito attivo. Talvolta, gli stessi substrati o prodotti possono fungere da modulatori allosterici.
La regolazione covalente consiste nell'aggiunta o rimozione di gruppi chimici addizionali, come i gruppi fosfato, favorendo o meno un aumento della velocità della reazione.
La rimozione di un piccolo peptide per proteolisi entra in gioco nell'attivazione di molti enzimi, come quelli coinvolti nella digestione e nella coagulazione del sangue.
L'inibizione dell'attività enzimatica
Le sostanze che in modo specifico rallentano o bloccano una reazione sono dette inibitori.
Molti farmaci sono inibitori di vie enzimatiche. L'aspirina, ad esempio, blocca la via enzimatica che porta alla produzione di sostanze responsabili della sensazione del dolore.
Gli inibitori vengono classificati come reversibili e irreversibili.
Gli inibitori reversibili possono essere:
- competitivi, se si legano nel sito attivo competendo con il substrato;
- incompetitivi se si legano in un sito diversi dal sito attivo;
- misti, se non si legano al sito attivo ma interagiscono sia con l'enzima libero sia con l'enzima legato al substrato.
Nell'inibizione reversibile è possibile ripristinare la normale attività catalitica una volta rimosso l'inibitore.
Gli inibitori irreversibili, invece, distruggono gruppi funzionali dell'enzima o si legano covalentemente ad esso compromettendone in modo definitivo l'attività.
Alcuni inibitori irreversibili sono detti suicidi: essi si legano al sito attivo e riescono a portare avanti le prime tappe della reazione, non formando il prodotto, ma un composto altamente reattivo che si lega irreversibilmente all'enzima.
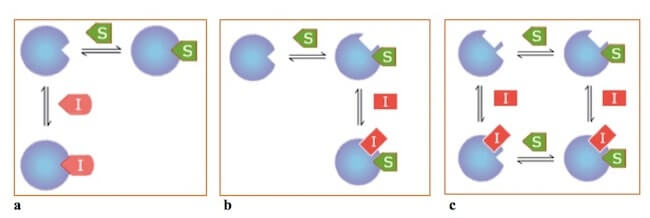
Le tre tipologie di inibizione reversibile: competitiva (a), incompetitiva (b) e mista (c).
Link correlati:
Che cosa è un isoenzima?
Cosa sono le mutazioni geniche?
Quali funzioni svolge l'enzima ATP Sintasi?
Che cosa sono gli enzimi isomerasi?
Studia con noi