Pila
Pila: principio di funzionamento
La pila è un dispositivo che trasforma l'energia chimica in energia elettrica. È un generatore (strutturato secondo i criteri che verranno spiegati più avanti) caratterizzato da un polo positivo (+) e da un polo negativo (-) tra i quali esiste una differenza di potenziale attiva (detta forza elettromotrice, comunemente abbreviata in f.e.m.) e capace di erogare corrente elettrica continua in un circuito esterno di utilizzazione che sia inserito tra i morsetti del polo positivo e del polo negativo.
Essa è costituita essenzialmente da due conduttori di prima classe (lamine metalliche o di carbone dette elettrodi) ciascuno dei quali immerso in un conduttore di seconda classe costituito da soluzioni elettrolitiche, sali fusi, solidi a conducibilità ionica, ecc.
Le pile possono essere così schematizzate:
(-) Me1| Soluzione1 || Soluzione2 | Me2 (+)
dove con il simbolo | si indica la superficie di separazione tra il conduttore di prima classe e la rispettiva soluzione, mentre con il simbolo || si indica il ponte salino o il setto poroso. La coppia Me | Soluzione costituisce un semielemento galvanico.
I due semielementi accoppiati costituiscono la cella galvanica detta comunemente pila. In questa simbologia, si scrive prima (e quindi a sinistra) il polo negativo della pila e a destra quello positivo.
Allorché si colleghino con un conduttore i due poli della pila, viene generata corrente elettrica a causa di una forza elettromotrice (o differenza di potenziale ddp) tra i due poli della pila.
In particolare succede che il materiale che costituisce l'elettrodo di prima classe del polo negativo si ossida e passa in soluzione nell'elettrodo di seconda classe, lasciando cariche negative sull'elettrodo.
Queste, attraverso il circuito esterno, giungono al polo positivo della pila dove provocano la riduzione dello ione positivo presente nell'elettrodo di seconda classe.
Per mantenere l'elettroneutralità dei due poli, le due soluzioni di seconda classe devono essere collegate da un setto poroso.
Un tipico esempio di pila, è la pila Daniell costituita da due elettrodi rispettivamente di rame e di zinco immersi in due soluzioni dei loro sali e collegate da un ponte salino; più in particolare essa è costituita da un elettrodo di zinco, funzionante da polo negativo, immerso in una soluzione acquosa di solfato di zinco posta in contatto, tramite un setto poroso, con una soluzione acquosa di solfato rameico in cui è immerso un elettrodo di rame, funzionante da polo positivo.
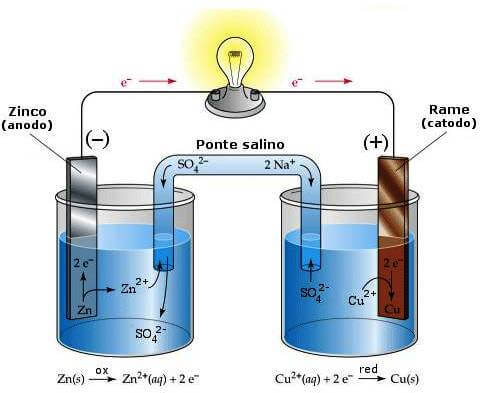
Pila Daniell.
Tale pila può essere schematizzata nel seguente modo:
(-) Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s) (+)
in cui la doppia barra // indica il ponte salino. Il processo complessivo è il seguente:
Zn + Cu2+ → Zn2+ + Cu
Se la concentrazione di entrambe le soluzioni è 1 M, alla temperatura di 25 °C la pila Daniell ha una f.e.m. di 1,10 V. Modificando la concentrazione di una o entrambe le soluzioni, o variando la temperatura del sistema, tale f.e.m. cambia di valore.
Alcune pile sono invece costituite da elettrodi identici immersi in due soluzioni a diversa concentrazione separate da un setto poroso o collegate da un ponte salino. È il caso delle pile a concentrazione.
Le pile alcaline trovano invece vasta applicazione pratica. Tra queste rivestono particolare importanza le pile a bottone, largamente utilizzate per apparecchi elettronici di piccole dimensioni.

Pile a bottone.
Se invece il conduttore di seconda classe è un solido, la pila corrispondente è detta pila a secco.
Gli accumulatori, meglio noti come batterie al piombo, costituiscono la pila ricaricabile più utilizzata e tuttora insostituibile in molte applicazioni.
Effetti energetici
La conversione dell'energia chimica in energia elettrica si effettua sfruttando gli effetti energetici originati dalla reazione chimica che tende a decorrere tra le due semicelle; tali effetti energetici sono misurati mediante le grandezze termodinamiche fondamentali: energia libera G, entalpia H, entropia S.
Per il decorrere di qualunque reazione chimica si verificano una variazione ΔG di energia libera (massima energia utilizzabile sotto forma di lavoro elettrico), una variazione ΔH di entalpia e una variazione ΔS di entropia, legate tra loro e con la f.e.m. E della pila dalla relazione:
ΔG = ΔH - T · ΔS = - n·F·E
in cui:
- T è la temperatura assoluta (K);
- F è la costante di Faraday (F = 96.487 C/mol);
- n è il numero di moli di sostanza trasformata.
Affinché la reazione avvenga spontaneamente ΔG deve assumere un valore negativo.
f.e.m. di una pila
Collegando un voltmetro alle due lamine metalliche di una qualsiasi pila, è possibile misurare il valore in volt della differenza di potenziale elettrico (o forza elettromotrice, f.e.m.) tra le due lamine.
La fem di una pila può essere determinata applicando la seguente formula:
![]()
in cui:
E°catodo è il potenziale standard di riduzione della reazione che avviene al catodo;
E°anodo è il potenziale standard di riduzione della reazione che avviene all'anodo.
Ricordiamo che il catodo assume sempre potenziale maggiore dell'anodo e in esso avviene la reazione di riduzione.
Riassumendo
Possiamo infine riassumere alcune regole generali, valide per qualunque tipo di pila.
1) Al contatto interfase in corrispondenza del polo negativo di una pila tende a decorrere spontaneamente una reazione elettrochimica di ossidazione; in tale reazione, cioè, la specie reagente coinvolta (ione, elemento chimico, o composto) tende tende ad assumere un numero di ssidazione più positivo o meno negativo (per esempio da -4 a - 3, da -1 a O, da O a + 1, da O a + 2, ecc.) cedendo contemporaneamente n elettroni all'elettrodo metallico interessato, il quale così si carica negativamente e diventa appunto polo negativo; esso è allora in grado di pompare elettroni nel circuito esterno.
2) Al contatto interfase corrispondente al polo positivo tende a decorrere spontaneamente una reazione elettrochimica di riduzione: la specie coinvolta tende cioè a diminuire il proprio numero di ossidazione (per esempio da + 4 a + 2, da + 2 a O come nella reazione, da O a -1, ecc.) sottraendo m elettroni all'elettrodo; esso in conseguenza si carica positivamente, diventando dunque il polo positivo della pila, e tende perciò a "succhiare" elettroni dal circuito esterno.
3) Nelle due reazioni elettrochimiche parziali di semipila, che concorrono insieme a determinare la reazione chimica globale della pila è coinvolto un identico numero n di elettroni dato dal prodotto di n con m; nella reazione chimica globale non figurano elettroni.
Esercizi sulle pile
Li trovi al seguente link: esercizi sulle pile.
Link correlati:
Che cos'è la densità di corrente elettrica?
Che cos'è e come funziona un accumulatore?
Che cos'è e come funziona un alimentatore?
Come avviene il collegamento in serie di batterie?
Esercizio sul calcolo della ddp ai capi di un generatore di tensione reale
Studia con noi