Costante di Faraday
Quanto vale la costante di Faraday?
La costante di Faraday, indicata con la lettera F,
Prende il nome in onore del fisico e chimico britannico
Michael Faraday.
Ricordando la definizione della costante di Faraday e sapendo che la carica elettrica di un singolo elettrone è pari a
e ≈ 1,602 · 10−19 C
e che una mole di elettroni è costituita da
NA ≈ 6,022 · 1023 mol-1,
è facile calcolare il valore della costante di Faraday.
Infatti:
F = e · Na ≈ 1,602 · 10−19 C · 6,022 · 1023 mol-1 ≈ 96400 C / mol
Il valore esatto della costante di Faraday è:
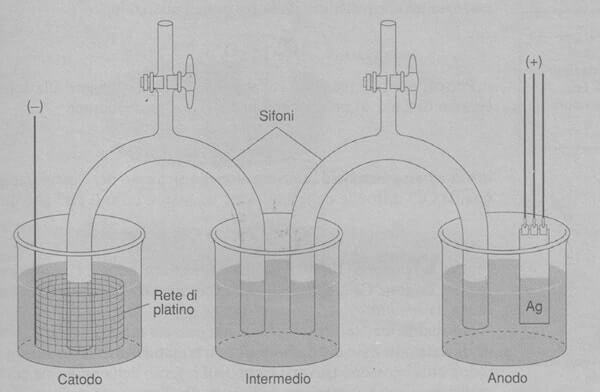
F = 96485 C / mol Il valore della costante di Faraday trova applicazione nei seguenti argomenti: La prima misura accurata della costante di Faraday è stata fatta tramite un esperimento coulombometrico di grande precisione condotto presso il National Bureau of Standards degli Stati Uniti. Un diagramma schematico dell'esperimento è rappresentato nella figura seguente: Il metodo consiste nella dissoluzione elettrolitica di un anodo di argento metallico di alta purezza in una soluzione acquosa di HCIO, 20% (m/m) contenente AgClO4, 0,5% (m/m). Anodo d'argento: Ag(s) → Ag+ + e− Catodo di platino: Ag+ + e− → Ag(s) È stato scelto questo elettrolita perché l'argento metallico è molto stabile in questa soluzione e non si scioglie spontaneamente. In un esperimento tipico, l'elettrolisi è stata eseguita utilizzando un voltaggio di 1,0182098 V ed una corrente elettrica di 0,203639 0 A per un tempo di 18 000,075 s. La perdita di massa all'anodo è stata di 4,097900 g. Il numero di Coulomb passati attraverso la cella è perciò: q = I · t = (0,203639O A) · (18000,075 s) = 3665,5173 C La quantità di argento ceduta dall'anodo è: moli di Ag = (4,097900 g) / (107,868 g/mol) = 3,79899 · 10-2 mol Coulomb e moli possono essere combinati per calcolare la costante di Faraday: F = coulomb / moli = (3665,5173 C) / (3,79899 · 10-2 mol) = 96485 C/mol Non tutto l'argento ceduto dall'anodo è stato ossidato. Una frazione (compresa tra lo 0,01% e il 15%) dell'Ag si è semplicemente staccata man mano che le parti adiacenti dell'elettrodo venivano elettrolizzate. Questo sedimento è stato raccolto e pesato alla fine dell'esperimento per ottenere la vera massa dell'argento ossidato. I bicchieri e i sifoni intermedi dell'apparecchiatura rappresentata in figura servono per separare fisicamente i compartimenti dell'anodo e del catodo. Ciò impedisce che l'Ag depositato sul catodo di platino si distacchi e venga pesato con il sedimento dell'anodo. È superfluo ricordare che per purificare l'anodo d'argento è stata necessaria la massima cura. Studia con noiMisura della costante di Faraday