Entalpia
Definizione di entalpia
Vuoi sapere come è definita l'entalpia?
Vuoi sapere che cos'è e come si calcola l'entalpia?
Se si continua con la lettura dell'articolo.
L'entalpia è una funzione di stato definita come somma dell'energia interna e del prodotto pressione per volume: H = E + P·V.
La entalpia è una proprietà del sistema; ciò significa che essa è univocamente determinata una volta noto lo stato in cui il sistema si trova; l'entalpia è inoltre una grandezza estensiva, dipendente cioè dall'estensione del sistema; si può quindi parlare di entalpia specifica (entalpia per unità di massa o per mole).
Fatta questa breve premessa, analizziamo nel dettaglio il significato fisico dell'entalpia e vediamo da quali relazioni matematiche può essere introdotta questa grandezza fisica.
Calcolo dell'entalpia
Riguardo al primo principio della termodinamica, si è visto che la variazione di energia interna di un sistema termodinamico, può essere calcolata con la seguente formula:
∆E = Q - L
in cui:
∆E = variazione di energia interna
Q = quantità di calore scambiato con l'ambiente
L = lavoro in gioco
Si è visto inoltre che per le trasformazioni fatte avvenire a pressione costante, il lavoro L può essere calcolato applicando la seguente formula:
L = P · ∆V = P · (V2 - V1)
Pertanto, nel caso di trasformazioni fatte avvenire a pressione costante, secondo il primo principio della termodinamica, la variazione di energia interna di un sistema può essere calcolata con la seguente formula:
∆E = E2 - E1 = Qp - P · (V2 - V1)
in cui:
- E2 = energia dello stato finale del sistema
- E1 = energia dello stato iniziale del sistema
- Qp = quantità di calore scambiata a pressione costante con l'ambiente
- V2 = volume finale del sistema
- V1 = volume iniziale del sistema
Ricavando il valore di Qp, si ha:
Qp = E2 - E1 + P · V2 - P · V1
ovvero:
Qp = (E2 + P · V2) - (E1 + P · V1)
La somma (E + P · V) viene indicata con la lettera H
H = E + P · V
e viene chiamata entalpia o contenuto termico totale di un sistema, in quanto con essa si tiene conto oltre che dell'energia delle particelle che costituiscono il sistema materiale (E), anche dell'energia determinata dalla pressione e dal volume del sistema stesso, la quale viene espressa tramite il prodotto P·V che ha le dimensioni di un lavoro (energia); per info si veda: unità di misura del lavoro.
Possiamo quindi scrivere:
Qp = H2 - H1 = ∆H
in cui ∆H è la variazione di entalpia tra gli stati 2 e 1.
Da questa formula risulta che: durante una trasformazione fatta avvenire a pressione costante la variazione di entalpia del sistema corrisponde al calore scambiato (calore di reazione).
La grandezza entalpia è quindi particolarmente conveniente nel caso di sistemi mantenuti a pressione costante; questo tipo di processo è molto frequente nella pratica (ad esempio qualsiasi processo che avviene a contatto con l'atmosfera è per sua natura isobaro) e perciò il concetto di entalpia è di comune utilizzazione.
L'entalpia nelle reazioni chimiche
Per una trasformazione chimica, la variazione di entalpia viene calcolata nel seguente modo:
ΔH = ΣH(prodotti) - ΣH(reagenti)
in cui:
- H(prodotti) è l'entalpia dei prodotti della reazione;
- H(reagenti) è l'entalpia dei reagenti della reazione.
Nelle reazioni che avvengono con un aumento di entalpia, l'entalpia dei prodotti H(prodotti) è maggiore dell'entalpia dei reagenti H(reagenti), per cui: ∆H > 0. Nel caso di reazioni fatte avvenire a pressione costante la reazione è endotermica.
Nelle reazioni che avvengono con diminuzione dell'entalpia, l'entalpia dei prodotti H(prodotti) è minore dell'entalpia dei reagenti H(reagenti), per cui: ∆H < 0. Nel caso di reazioni fatte avvenire a pressione costante la reazione è esotermica.
L'entalpia è una funzione di stato
L'entalpia H è una funzione di stato perché definita come somma di funzioni di stato.
Funzione di stato significa che valori che i valori assunti dall'entalpia dipendono unicamente dalle condizioni in cui si trova il sistema e sono indipendenti dal modo in cui quel sistema è stato ottenuto. Oltre all'entalpia, sono funzioni di stato la temperatura, l'energia, il volume, la pressione e l'entropia.
Trasformazioni isoentalpiche (trasformazioni che avvengono con variazione di entalpia nulla)
Consideriamo un cilindro isolato termicamente e dotato di due pistoni adiabatici agli estremi; tra i pistoni si trova un setto poroso (lo stesso effetto può essere ottenuto sostituendo al setto poroso una strozzatura dalla luce molto ridotta o una parete dotata di minuscoli forellini).
Nelle condizioni iniziali tra il pistone che si trova a una estremità e il setto poroso c'è un gas che occupa il volume V1, alla pressione p1; l'altro pistone si trova a ridosso del setto poroso.
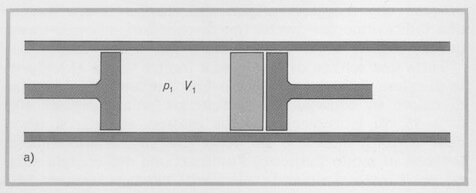
Cilindro isolato termicamente con due pistoni adiabatici fra i quali esiste un setto poroso (rettangolo in grigio chiaro). Il gas occupa il volume V1 a sinistra del setto.
Immaginiamo di spostarci da questa condizione iniziale di equilibrio muovendo simultaneamente nella stessa direzione entrambi i pistoni, in modo da conservare la pressione costante p1 da una parte del setto e la pressione p2 < p1 dalla parte opposta.
Quando tutto il gas è fluito al di là del setto poroso e il primo pistone si trova a ridosso del setto, il gas si trova a occupare il volume V2 alla pressione p2. Questo processo si dice di "laminazione".
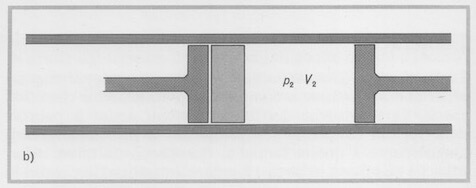
Il gas occupa il volume V2 a destra del setto.
Il processo di laminazione è evidentemente irreversibile in quanto il gas, per passare dallo stato di equilibrio iniziale a quello finale, passa per tutta una serie di stati che non sono di equilibrio e non possono essere descritti mediante delle coordinate termodinamiche.
Applicando il primo principio della termodinamica all'intero processo e ricordando che la trasformazione è avvenuta senza scambi di calore, otteniamo:
E2 - E1 = L
Il lavoro totale scambiato nel corso del processo vale:
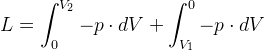
e poiché entrambe le pressioni sono rimaste costanti si ha:
L = - p2 · V2 + p1 · V1
sarà perciò:
E2 - E1 = - p2 · V2 + p1 · V1
Ovvero:
E2 + p2 · V2 = E1 + p1 · V1
E quindi:
H2 = H1
In un processo di laminazione il valore finale e quello iniziale di entalpia coincidono. Non si può dire che l'entalpia sia rimasta costante durante tutto il processo in quanto essa è definita solo per gli stati di equilibrio: in un diagramma termodinamico si possono perciò rappresentare solo gli stati iniziale e finale di questa trasformazione ma non quelli intermedi.
Riassunto sull'entalpia
1) L'entalpia si calcola con la seguente somma: H = E + P·V
2) L'entalpia è una funzione di stato.
3) In una trasformazione fatta avvenire a pressione costante la variazione di entalpia del sistema corrisponde al calore scambiato.
4) In una trasformazione chimica, la variazione di entalpia viene calcolata nel seguente modo: ΔH = ΣH(prodotti) - ΣH(reagenti)
5) Se una reazione chimica viene fatta avvenire a pressione costante e la variazione di entalpia ΔH è < 0, la reazione è esotermica.
6) Se una reazione chimica viene fatta avvenire a pressione costante e la variazione di entalpia ΔH è > 0, la reazione è endotermica.
7) Esitono trasformazioni che avvengono con variazione di entalpia nulla.
Studia con noi