Pila Daniell
Pila Daniell: principio di funzionamento
Le celle galvaniche dette anche pile sono dispositivi capaci di sfruttare reazioni di ossido-riduzione spontanee per trasformare energia chimica di legame in energia elettrica.
Sono costituite essenzialmente da due conduttori di prima classe (lamine metalliche o di carbone dette elettrodi) ciascuno dei quali immerso in un diverso conduttore di seconda classe costituito solitamente da una soluzione elettrolitica.
Le pile possono essere così schematizzate:
(-) Me1| Soluzione1 || Soluzione2 | Me2 (+)
Un tipico esempio di cella galvanica è la pila Daniell, il cui principio di funzionamento è di seguito esposto.
Come funziona una pila Daniell
Immergendo una barretta di zinco all'interno di una soluzione contenente ioni Cu2+, è possibile notare l'ossidazione dello zinco a Zn2+ e la contemporanea riduzione degli ioni Cu2+ a rame metallico.

Reazione spontanea tra Zn e ioni Cu2+. Lo zinco metallico si ossida a ioni Zn2+ e gli ioni Cu2+ si riducono a rame metallico.
Il processo complessivo è il seguente:
Zn + Cu2+ → Zn2+ + Cu
È possibile sfruttare tale reazione per ottenere energia elettrica separando la semireazione di ossidazione dello zinco:
Zn → Zn2+ + 2e−
dalla semireazione di riduzione del rame:
Cu2+ + 2e− → Cu
È sufficiente immergere una barretta di zinco metallico all'interno di una soluzione di solfato di zinco (ZnSO4) che, dissociandosi completamente, fornisce gli ioni Zn2+ e immergere una barretta di rame metallico all'interno di una soluzione di solfato di rame (CuSO4) che, dissociandosi completamente fornisce gli ioni Cu2+.

Finché le due semicelle rimangono separate non avviene nessuna reazione. Però, se colleghiamo con un filo conduttore le due lamine metalliche, lo zinco, che ha rispetto al rame una maggiore tendenza ad ossidarsi, perde elettroni che, passando attraverso il circuito elettrico esterno vengono attratti dagli ioni rameici Cu2+ che acquistandoli si riducono a rame metallico.
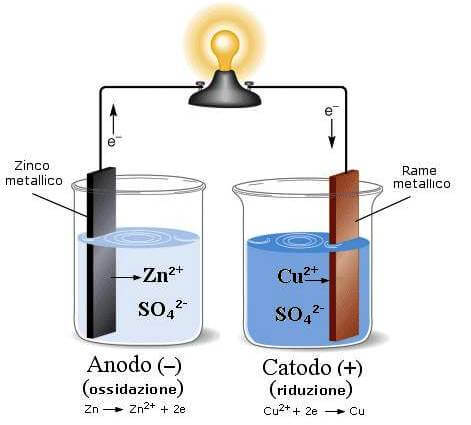
Per convenzione l'elettrodo al quale avviene il processo di ossidazione è detto anodo e costituisce il polo negativo della pila, mentre l'elettrodo al quale viene il processo di riduzione è detto catodo e risulta essere il polo positivo della pila.
All'anodo lo zinco metallico si ossida e passa in soluzione come ione Zn2+ e pertanto la soluzione di solfato di zinco si arricchisce di ioni Zn2+; al catodo gli ioni Cu2+ si riducono a rame metallico e pertanto la soluzione di solfato rameico si impoverisce di ioni Cu2+.
In queste condizioni l'anodo tende a caricarsi positivamente mentre il catodo tende a caricarsi negativamente.
Ciò provoca la perdita dell'elettroneutralità delle due soluzioni e il passaggio di corrente elettrica si esaurisce in brevissimo tempo in quanto gli elettroni dovrebbero abbandonare una semicella carica positivamente che li attrae per dirigersi verso una semicella carica negativamente che li respinge.
È pertanto necessario collegare le due soluzioni attraverso un dispositivo chiamato ponte salino che garantisce l'elettroneutralità delle due soluzioni.
Esso è costituito da un tubo ad U contenente una soluzione molto concentrata di un elettrolita forte come ad esempio Na2SO4 che, dissociandosi in ioni Na+ ed SO42− fornisce ioni Na+ alla soluzione catodica e ioni SO42− alla soluzione anodica.
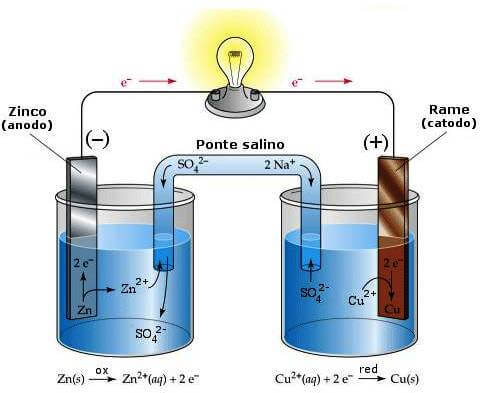
Schema di funzionamento della pila Daniell: lo zinco metallico tende a ridurre indirettamente gli ioni Cu2+ a rame metallico; ossidandosi a ione Zn2+ causa l'erogazione di elettroni al circuito esterno. Questi sono poi captati dal polo positivo per cui vi si deposita rame. Il ponte salino mantiene l'elettroneutralità tra le due soluzioni.
La pila così costituita nota come pila Daniell, può essere schematizzata nel seguente modo:
(-) Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s) (+)
La doppia barra // indica il ponte salino. Come già detto in precedenza il processo complessivo è il seguente:
Zn + Cu2+ → Zn2+ + Cu
Se andiamo a verificare lo stato del sistema dopo che la pila ha erogato un certo quantitativo di energia elettrica, possiamo rilevare che sono avvenute alcune trasformazioni, e precisamente: la lamina di rame è aumentata di peso, mentre quella di zinco si è in parte disciolta.
Se la concentrazione di entrambe le soluzioni è 1 M, alla temperatura di 25 °C la pila Daniell ha una f.e.m. di 1,10 V. Modificando la concentrazione di una o entrambe le soluzioni, o variando la temperatura del sistema, tale f.e.m. cambia di valore.
Calcolo della f.e.m. della pila Daniell
Collegando un voltmetro alle due lamine metalliche di una pila Daniell, è possibile misurare il valore in volt della differenza di potenziale elettrico (o forza elettromotrice, f.e.m.) tra le due lamine.
In linea teorica, la fem di una pila può essere invece determinata applicando la seguente formula:
![]()
in cui:
- E°catodo è il potenziale standard di riduzione della reazione che avviene al catodo;
- E°anodo è il potenziale standard di riduzione della reazione che avviene all'anodo.
Nel caso della pila Daniell si ha che, nelle condizioni standard:
E°catodo = E°Cu2+/Cu = 0,34 V
E°anodo = E°Zn2+/Zn = - 0,76 V
Quindi:
fem = 0,34 - (- 0,76) = 0,34 + 0,76 = 1,10 V
Pertanto, come già detto in precedenza, la fem della pila Daniell nelle condizioni standard è pari a 1,10 V.
Esercizi sulle pile
Li trovi al seguente link: esercizi sulle pile.
Link correlati:
Che cos'è l'ampere-ora e a cosa corrisponde?
Qual è la differenza tra anodo e catodo?
Studia con noi