Forza elettromotrice
Forza elettromotrice di una pila
Collegando un voltmetro alle due lamine metalliche di una pila Daniell o di una qualsiasi altra pila, è possibile misurare il valore in volt della differenza di potenziale elettrico tra le due lamine.
La differenza di potenziale elettrico misura il lavoro necessario per spostare l'unità di carica elettrica tra due punti; in altre parole, la differenza di potenziale misura la capacità della pila di spingere gli elettroni liberati all'anodo lungo il circuito esterno, verso il catodo.
L'unità di misura della differenza di potenziale (ddp), detta anche forza elettromotrice (fem) o voltaggio, è il volt.
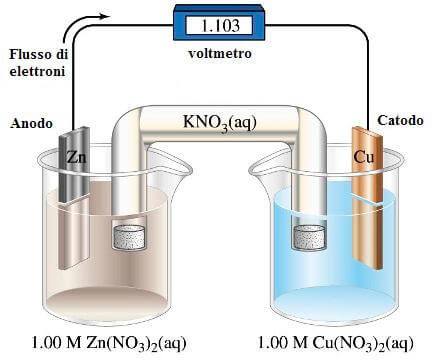
Pila Daniell
La differenza di potenziale dipende, oltre che dalla natura chimica dei reagenti, anche dalla temperatura e dalla concentrazione delle specie chimiche.
Mentre è possibile determinare il valore della forza elettromotrice di una pila, non è possibile determinare il valore assoluto del potenziale di ciascuna semicella.
Una semicella isolata, infatti, non produce nessuna reazione chimica ed inoltre, se collegata ad una seconda semicella, può fungere sia da catodo che da anodo a seconda della forza con cui la coppia redox della seconda semicella tende ad ossidarsi o a ridursi.
Per tale motivo è stata scelta arbitrariamente una semicella alla quale è stato assegnato convenzionalmente il valore di potenziale uguale a zero.
La semicella presa come riferimento è nota come elettrodo standard ad idrogeno e corrisponde alla coppia redox H+/H2.
Poiché i potenziali vengono espressi in termini di riduzione di ciascuna coppia redox, tutte le coppie redox che si riducono rispetto all'idrogeno assumono un potenziale positivo mentre, tutte le coppie redox che si ossidano rispetto all'idrogeno, assumono un potenziale negativo.
I valori di fem misurati rispetto ad ogni coppia redox, prendono il nome di potenziali di riduzione standard e vengono indicati con E°.
Il potenziale di riduzione standard viene determinato alla temperatura di 25°C e con le specie chimiche alla concentrazione 1M (eventuali gas devono essere alla pressione parziale di 1 atm).
Prese due coppie redox, quella a potenziale standard maggiore si riduce mentre quella con potenziale standard inferiore si ossida.
La fem della pila così costruita può essere determinata applicando la seguente formula:
![]()
ricordando che il catodo assume sempre potenziale maggiore dell'anodo e in esso avviene la reazione di riduzione.
Esercizi sulle pile
Li trovi al seguente link: esercizi sulle pile.
Link correlati:
Esercizi svolti e commentati sulle pile
Esercizio sul calcolo del potenziale di elettrodo
Che cos'è un bipolo?
Come avviene il collegamento in parallelo di batterie?
Studia con noi