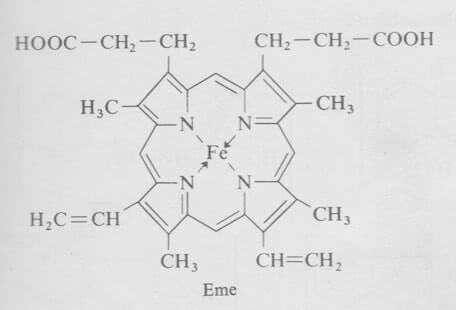
Gruppo eme
Proprietà del gruppo eme
Il gruppo eme è un complesso formato da un atomo di ferro bivalente e da una molecola di protoporfirina IX (si veda: porfirine e protoporfirine), di formula C34H32FeN4O4, di massa molare pari a 616,50 g/mol.
L'eme costituisce il gruppo prostetico (cioè la parte non proteica) dell'emoglobina - e di altre cromoproteine respiratorie quali la mioglobina e i citocromi - alla quale conferisce il colore rosso e la possibilità di funzionare da trasportatore di ossigeno, elemento che si lega reversibilmente all'atomo di ferro presente nella molecola dell'eme.
L'emoglobina è infatti costituita da una porzione proteica chiamata globina ed un complesso ferro/porfirina chiamato appunto eme.
L'atomo di ferro nell'eme è nello stato di ossidazione ferroso (Fe2+). L'emina è invece la forma ossidata dell'eme.
La funzione dell'emoglobina nel sangue è quella di trasportare l'ossigeno ai tessuti. Questo trasporto viene effettuato mediante il complesso del ferro esacoordinato nel quale l'atomo di ferro dell'unità eme è coordinato anche con l'azoto imidazolico della proteina globina e con una molecola di ossigeno.
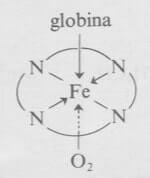
Trasporto di ossigeno da parte della emoglobina.
L'ossido di carbonio agisce come veleno perché il CO forma un complesso con l'emoglobina molto più stabile di quello dell'ossigeno.
Anche concentrazioni abbastanza basse di CO nell'aria possono provocare morte per soffocamento, bloccando la maggior parte della emoglobina nella corrente sanguigna.
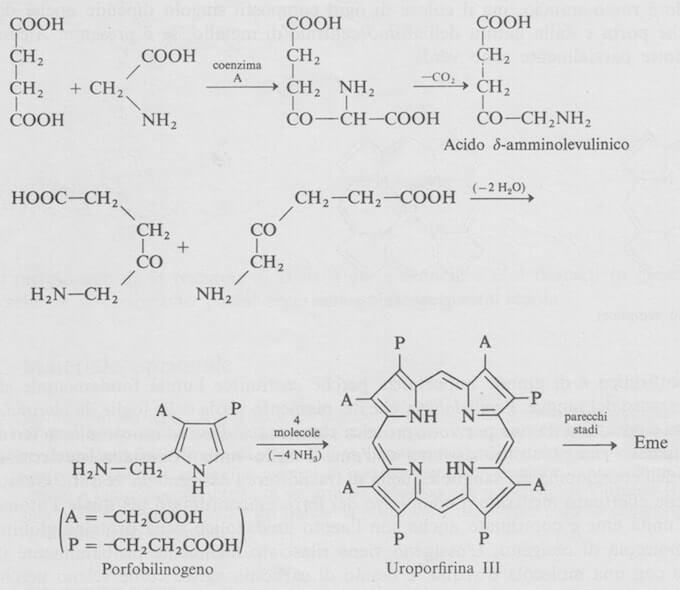
Biosintesi dell'eme
Negli anni recenti i biochimici sono stati in grado di chiarire gli stadi principali nella biogenesi dell'eme.
La glicina (HOOC-CH2-NH2) condensa con il succinilcoenzima A, ovvero la forma attiva dell'acido succinico (HOOC-CH2-CH2-COOH) per dare l'acido α-ammino-ß-chetoadipico che decarbossila ad acido δ-amminolevulinico.
Due molecole di quest'ultimo condensano assieme in una reazione analoga alla sintesi di Knorr del pirrolo, portando a un pirrolo sostituito noto come porfobilinogeno.
Quattro molecole di porfobilinogeno vengono condensate assieme, con perdita di ammoniaca, portando a un composto chiamato uroporfirina III, che, come implica il nome, è stata anche isolata dalle urine.
Occorre notare che la condensazione che forma la uroporfirina III è insolita perché una delle quattro unità pirroliche ha l'orientamento opposto a quello delle altre unità, portando così a una porfirina sostituita in modo non simmetrico.
Infine la conversione della uroporfirina III a eme è relativamente semplice, e coinvolge la decarbossilazione di tutte le unità di acido acetico a gruppi metilici, e la degradazione di due catene di acido propionico a vinili, seguita dall'inserzione dell'atomo di ferro.
Schema riassuntivo della biosintesi del gruppo eme
Link correlati:
Qual è il gruppo arilico?
Studia con noi