Pila a combustibile
Principio di funzionamento di una pila a combustibile
Enormi vantaggi economici si avrebbero dalla realizzazione di un sistema che consentisse di trasformare l'energia chimica dei combustibili direttamente in energia elettrica, evitando il passaggio attraverso l'energia termica; questo passaggio infatti comporta rese energetiche dell'ordine del 30%, mentre la trasformazione diretta potrebbe consentire rese prossime al 100% .
Si cerca di realizzare tale trasformazione diretta mediante le pile a combustibile, anche se la soluzione del progetto è tuttora piuttosto lontana. Pertanto, le pile a combustibile sono una particolare classe di generatori elettrochimici, in cui viene generata energia elettrica sfruttando la variazione di energia chimica associata alla reazione di ossidazione di un combustibile.
La combustione è un processo di ossidoriduzione (il combustibile viene ossidato dall'ossigeno) ed è perciò suscettibile, come ogni reazione redox, di avvenire in una adatta pila.
Ad esempio la combustione dell'etano, idrocarburo gassoso:
C2H6 + 3,5 O2 → 2 CO2 + 3 H2O + 1560 kJ
può farsi avvenire nel cilindro di un motore a combustione interna, producendo energia meccanica con una resa che si aggira attorno al 30%.
N.B. = 1560 kJ rappresenta il calore di combustione.
La stessa reazione può avvenire, con una resa in energia elettrica di circa il 95% in una pila a combustibile che scinde la reazione precedente nelle due semireazioni elettrodiche:
(polo +) 3,5 O2 + 7 H2O + 14 e− → 14 OH−
(polo -) C2H6 + 14 OH− → 2 CO2 + 10 H2O + 14 e−
----------------
Reazione globale:
C2H6 + 3,5 O2 → 2 CO2 + 3 H2O
L'elettrodo positivo della pila, su cui avviene la riduzione dell'ossigeno, è costituito da nichel poroso mantenuto saturo di ossigeno o di aria, e quello negativo, su cui avviene l'ossidazione dell'etano, è costituito da carbone poroso mantenuto saturo di etano.
I due elettrodi sono a contatto con una soluzione concentrata di KOH, e sulla loro superficie sono presenti catalizzatori che aumentando la velocità delle reazioni elettrodiche consentono alla pila di erogare correnti di intensità conveniente.
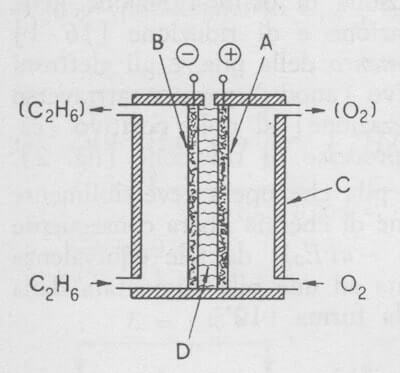
Schema di una pila a combustibile: A) nichel poroso con catalizzatore (polo +); B) carbone poroso con catalizzatore (polo -); C) contenitore; D) soluzione acquosa di KOH.
Le uniche pile a combustibile oggi prodotte dall'industria, sono quelle ad idrogeno-ossigeno, che impiegano cioè l'idrogeno come combustibile.
Pila a idrogeno-ossigeno
Nella figura seguente è rappresentato lo schema di principio del funzionamento di una tipica pila a combustibile idrogeno/ossigeno a elettrolita alcalino.
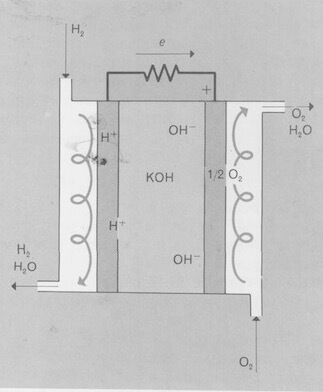
Pila a idrogeno e ossigeno costituita da una soluzione elettrolitica (KOH) entro cui sono immersi due elettrodi (di platino o di nichel poroso) in contatto con i gas. L'elettrodo a ossigeno funge da polo positivo mentre l'elettrodo a idrogeno fa da polo negativo.
In essa avvengono le seguenti reazioni elettrodiche:
(polo -) H2→ 2 H+ + 2 e−
(polo +) ½ O2 + H2O + 2 e− → 2 OH−
----------------
Reazione globale:
H2 + ½ O2 → H2O
Gli elettrodi sono costituiti da materiali porosi con proprietà catalitiche per le rispettive reazioni elettrodiche: l'ossidazione dell'idrogeno (al polo negativo) e la riduzione dell'ossigeno (al polo positivo) hanno luogo nelle zone di triplice contatto gas-soluzione-catalizzatore.
La pila ad H2/O2 non risolve però il problema centrale che è quello di poter utilizzare in queste pile i combustibili convenzionali (gas naturali e prodotti petroliferi).
L'applicazione delle pile a combustibile incontra infatti forti difficoltà per la notevole complessità ingegneristica del sistema e per il costo dei catalizzatori (a base di metalli del gruppo del platino).
In ogni caso, le intense ricerche sulle pile a combustibile hanno portato a un grande progresso delle conoscenze fondamentali di elettrocatalisi e dei fenomeni di trasporto in elettrochimica e a tentativi di applicazioni innovatrici in vari settori.
Breve storia degli studi sulla pila a combustione
L'idea di sfruttare per via elettrochimica l'energia chimica liberata nella reazione tra un combustibile e l'ossigeno, risale alla prima metà del XIX secolo: nel 1839 W. Grove realizzò la prima pila H2/O2 a elettrolita acido.
Le ricerche proseguirono saltuariamente nel corso degli anni, senza peraltro risultati significativi. La prima pila a combustibile di interesse pratico venne realizzata da F. T. Bacon nel 1959 (pila H2/O2 da 5 kW funzionante a 200 °C con elettrolita alcalino).
I successivi 20 anni sono stati caratterizzati da un notevole sforzo scientifico e tecnologico nel settore, sotto la spinta del problema spaziale.
La principale applicazione pratica riguarda infatti questo settore: le pile H2/O2, hanno contribuito in modo determinante al successo delle imprese spaziali Gemini e Apollo, fornendo l'energia elettrica necessaria e l'acqua per gli astronauti, prodotta durante il funzionamento e resa quindi potabile.
Differenza tra pile a combustione e batterie elettriche
La differenza essenziale fra queste pile e le batterie elettriche consiste nell'immagazzinamento dei reattivi esternamente all'elettrodo.
Solitamente, infatti, nelle pile a combustione, sia il combustibile (idrogeno, idrocarburi) sia l'ossidante (ossigeno, aria, cloro) sono allo stato gassoso e vengono conservati esternamente alla cella in opportuni serbatoi; nelle pile indirette, il combustibile viene prodotto in loco con microimpianti chimici (per esempio, idrogeno da reforming di idrocarburi o metanolo o da pirolisi dell'ammoniaca).
Link correlati:
Che cos'è l'ampere-ora e a cosa corrisponde?
Studia con noi