Calore di combustione
Che cos'è il calore di combustione?
Il calore di reazione è la quantità di calore sviluppata in una reazione chimica; se quest'ultima è una reazione di combustione, il calore di reazione viene detto calore di combustione.
Ancora più nel dettaglio, se la quantità di sostanza che si comporta da combustibile corrisponde ad una mole, il calore di combustione è detto calore di combustione specifico.
Il calore di combustione è quindi il calore sviluppato in una reazione di combustione; queste ultime sono reazioni chimiche che avvengono tra un combustibile e un comburente, solitamente ossigeno. Tali tipi di reazioni sono da un punto di vista cinetico molto veloci in quanto il calore sviluppato accelera la reazione stessa.
I valori dei calori di combustione variano con la temperatura alla quale si effettua la combustione stessa; questa dipendenza è definita dalla legge di Kirchhoff.
Calore di combustione superiore o inferiore
Nella combustione di sostanze che contengono idrogeno si ottiene l'acqua; l'acqua prodotta può essere allo stato di vapore (vapore acqueo) o allo stato liquido.
A seconda che l'acqua prodotta sia allo stato liquido o di vapore, si definisce un calore di combustione superiore o inferiore.
Calore di combustione ed entalpie di formazione
Conoscendo il calore di combustione di una sostanza è possibile, in genere, determinare le entalpie di formazione: consideriamo ad esempio un generico idrocarburo CnHm.
Tale idrocarburo brucia secondo la seguente reazione chimica:
![]()
nella quale gli indici (l) e (g) indicano rispettivamente:
- l = sostanza allo stato liquido;
- g = sostanza allo stato gassoso.
Per determinare l'entalpia di formazione (ΔHf) - alla temperatura di combustione - dell'idrocarburo CnHm, è sufficiente applicare la seguente relazione matematica:
![]()
nella quale:
- ΔHf[CO2(g)] è l'entalpia di formazione dell'anidride carbonica gassosa (valore noto);
- ΔHf[H2O(l)] è l'entalpia di formazione dell'acqua liquida (valore noto);
- ΔHc è l'entalpia di combustione, ovvero il calore di combustione con il segno cambiato (vale pertanto: Qc = - ΔHc).
Di seguito elenchiamo i valori delle entalpie standard di combustione (ΔH°c) (a 25°C) di alcune sostanze. Come è possibile notare si tratta di valori negativi; non bisogna infatti scordare che quando ΔH < 0 si ha una trasformazione esotermica con sviluppo quindi di calore.
1) benzene (C6H6) = -3268 kJ/mol
2) carbonio (C) = - 394 kJ/mol
3) Etanolo (CH3CH2OH) = -1368 kJ/mol
4) Etino (CH≡CH) = -1300 kJ/mol
5) Glucosio (C6H12O6) = -2808 kJ/mol
6) Idrogeno (H2) = -286 kJ/mol
7) Metano (CH4) = -890 kJ/mol
8) Propano (C3H8) = -2220 kJ/mol
Determinazione sperimentale del calore di combustione
Il calore di combustione può essere determinato sperimentalmente utilizzando un particolare calorimetro noto come bomba calorimetrica (o bomba calorimetrica di Mahler).
Si tratta di un piccolo recipiente di acciaio con pareti spesse, ermeticamente chiuso, in cui è posta una piccola capsula di porcellana contenente la sostanza da esaminare; tale sostanza viene successivamente combusta mediante una resistenza elettrica "immersa" nella sostanza stessa. Opportune valvole regolano l'immissione dell'ossigeno - necessario per la combustione - nel recipiente di acciaio.
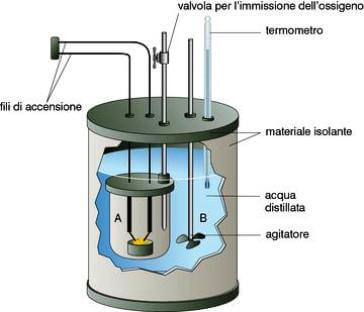
Bomba calorimetrica o bomba di Mahler.
Quest'ultimo, a sua volta, è immerso in un altro recipiente isolato termicamente da materiale isolante e riempito di acqua. Il calore prodotto nella combustione della sostanza in esame, viene assorbito dall'acqua che quindi si riscalda.
Applicando infine la legge fondamentale della termologia è possibile risalire alla quantità di calore emessa durante la combustione. Per ogni ulteriore approfondimento si veda bomba calorimetrica.
Esercizio
Si calcoli la quantità di benzene che occorre bruciare per riscaldare 1,0 kg di acqua dalla temperatura di 20°C alla temperatura di 30°C.
Si sappia che il calore specifico dell'acqua è pari a 4,186 J/g°C e che l'entalpia standard di combustione ΔH°c del benzene è -3268 kJ/mol.
Svolgimento dell'esercizio
Applichiamo la formula della legge fondamentale della termologia e calcoliamo la quantità di calore necessaria per riscaldare 1,0 kg (= 1000 g) di acqua dalla temperatura di 20°C alla temperatura di 30°C
Q = 1000 ∙ 4,186 ∙ (30 - 20) = 4,186 ∙ 104 J = 41,86 KJ
Poiché dalla combustione di 1 mole di benzene si ottengono 3268 kJ risulta che:
moli di benzene necessarie = 41,86/3268 = 0,0128 mol
Calcoliamo infine la massa di benzene moltiplicando il numero di moli per il valore della massa molare del benzene (= 78,11 g/mol):
massa di benzene necessaria = 0,0128 mol ∙ 78,11 g/mol = 1,0 g
Link correlati:
Che cos'è il calore?
Che cos'è la capacità termica?
Studia con noi