Idrazina
Caratteristiche e proprietà dell'idrazina
L'idrazina è un composto con formula chimica N2H4 (H2N-NH2; energia del legame N-N 170 kJ/mol).
Presenta la seguente struttura:
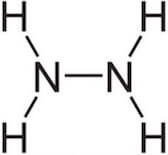
È un liquido incolore che congela a 1,4°C e bolle a 113,5°C; ha elevata costante dielettrica (ε(25°C) = 52).
È solubile in acqua, con la quale forma un azeotropo contenente 71,5% di N2H4; dalla soluzione può separarsi un idrato di idrazina N2H4·H2O, analogo all'idrato di ammoniaca NH3·H2O.
L'idrazina, come l'ammoniaca, scioglie i metalli alcalini, ma le soluzioni sono meno stabili:
2 Na + 2 N2H4 → 2 NaN2H3 + H2
Ricordiamo inoltre che N2H4 è un energico riducente:
N2H4 + 4 OH− ⇄ N2 + 4 H2O + 4e− (E° = -1,16 V)
e, come l'NH3, ha proprietà basiche, anche se più deboli, dovute alla presenza di due lone pairs nella molecola. È una base biacida:
- N2H4 + H2O ⇄ N2H5+ + OH−
- N2H5+ + H2O ⇄ N2H62+ + OH−
in cui:
- (Ka1 = 1·10-6)
- (Ka1 = 1·10-15)
I sali di N2H5+ sono stabili in acqua, quelli di N2H62+ sono fortemente idrolizzati.
I sali derivati dalla reazione di un acido con idrazina prendono il nome di sali di idrazonio, in analogia ai sali di ammonio.
Ad esempio N2H5Cl (cloruro di idrazonio), prende origine dalla seguente reazione chimica:
N2H4 + HCl → N2H5Cl
Preparazione dell'idrazina
L'idrazina viene preparata industrialmente (processo Raschig, 1907) per ossidazione dell'ammoniaca con ipoclorito di sodio (NaClO), che ossida l'atomo N da -3 (NH3) a -2 (N2H4):
2 NH3 + NaClO → N2H4 + NaCl + H2O
Dalla soluzione l'idrazina viene poi separata per distillazione, oppure precipitandola come solfato di idrazonio, poco solubile a temperatura ambiente, e ottenendola poi da questo, anidra, per reazione con NH3 liquida:
N2H6SO4 + 2 NH3 → (NH4)2SO4↓ + N2H4
L'idrazina, come l'NH3, subisce autoionizzazione:
2 N2H4 ⇄ N2H5+ + N2H3−
Infine ricordiamo che, in presenza di aria, l'idrazina può bruciare con reazione notevolmente esotermica:
N2H4 + O2 → N2 + 2 H2O + 620 kJ
Reazioni caratteristiche dell'idrazina
L'idrazina viene utilizzata nella preparazione dello ioduro di idrogeno secondo la seguente reazione chimica:
2 I2 + N2H4 → 4 HI + N2
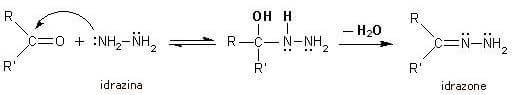
L'idrazina con i suoi due gruppi amminici può sottostare a una mono- o a una bi-condensazione con le aldeidi e i chetoni. Nella reazione seguente viene messa in evidenza la mono-condensazione con formazione di un idrazone.
N2H4 viene utilizzata anche nella riduzione di aldeidi e chetoni (riduzione di Wolff-Kishner). Aldeidi e chetoni infatti vengono infatti ridotti a idrocarburi in presenza di un eccesso di idrazina e di basi forti a temperature elevate.
Come solvente conveniente per la reazione si usa il glicole etilenico.
L'acqua formata durante la reazione abbassa il punto di ebollizione della miscela così che la reazione viene condotta a completamento distillando via l'acqua.
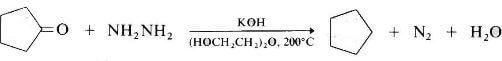
Studia con noi