Passaggi di Stato
Generalità e proprietà dei passaggi di stato
Vuoi sapere che cosa sono i passaggi di stato?
Vuoi sapere quanti sono e come vengono denominati i vari passaggi di stato?
Se si continua con la lettura dell'articolo.
In questa lezione vedremo infatti che cosa sono i passaggi di stato, quanti sono e come vengono denominati.
Per ognuno di essi porteremo uno o più esempi di sostanze che effettuano quel passaggio di stato e infine forniremo uno schema riassuntivo di tutti i passaggi di stato che avvengono in natura.
La materia possiede la capacità di poter trasformare il suo stato fisico se sottoposta a variazioni di temperatura o di pressione o di entrambe queste grandezze.
Le trasformazioni da uno stato fisico a un altro vengono chiamate passaggi di stato.
Un cubetto di ghiaccio lasciato a temperatura ambiente si trasforma rapidamente in acqua liquida; allo stesso modo riscaldando la cera di una candela questa inizia a fondere; persino il ferro se riscaldato ad alte temperature diventa liquido. Questi sono tutti esempi di passaggi di stato.
Si possono ottenere passaggi di stato della materia anche attraverso variazioni di pressione.
Se proviamo infatti a fare fuoriuscire il combustibile liquido di un accendino, questo, a causa della diminuzione di pressione, si trasforma in gas.
In particolare si hanno i seguenti passaggi di stato:
1. fusione
La fusione è il passaggio dallo stato solido a quello liquido; il ghiaccio fonde quando viene lasciato a temperatura ambiente. Tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico.
Durante la fusione di una sostanza pura, la temperatura del sistema rimane costante.
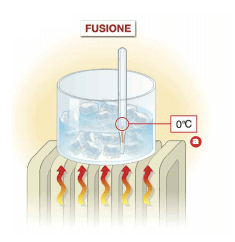
Durante la fusione del ghiaccio la temperatura rimane fissa a 0°C (alla pressione di 1 atm).
2. evaporazione
L'evaporazione è il passaggio dallo stato liquido a quello aeriforme; l'acqua di un bicchiere lasciata a temperatura ambiente evapora.
Tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico.
3. ebollizione
L'ebollizione è il passaggio tumultuoso dallo stato liquido a quello aeriforme; mettendo una pentola d'acqua sul fornello, noteremo che inizialmente l'acqua si riscalda e dopo un po' di tempo inizia a bollire: all'interno della massa d'acqua si ha la formazione di bolle, che, risalendo in superficie, sfuggono attraverso essa.
Tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico.
Durante l'ebollizione di una sostanza pura, la temperatura del sistema rimane costante.

Durante l'ebollizione dell'acqua la temperatura rimane fissa a 100°C (alla pressione di 1 atm).
La condensazione (che è l'inverso della evaporazione) è il passaggio dallo stato aeriforme (vapore) allo stato liquido; quando l'acqua contenuta in una pentola bolle, noteremo sul vetro della finestra e sulle piastrelle della cucina vicino alla pentola la formazione di minuscole goccioline di acqua (condensa) dovute al processo di condensazione del vapore acqueo.
Tale trasformazione avviene con cessione di calore ed è quindi un processo esotermico; durante la condensazione di una sostanza pura, la temperatura del sistema rimane costante.
La condensazione del vapore acqueo nell'atmosfera è il processo che porta alla formazione di nubi e quindi di precipitazioni atmosferiche.
5. liquefazione
La liquefazione è il passaggio dallo stato gassoso allo stato liquido che si ha per compressione (più eventuale abbassamento di temperatura); alcuni gas, come quelli presenti negli accendini, possono essere portati allo stato liquido per sola compressione.
Tali gas, compressi ad opportune pressioni, vanno incontro al processo di liquefazione. Tale trasformazione avviene con cessione di calore ed è quindi un processo esotermico.
La liquefazione non è da confondere con la condensazione che invece riguarda i vapori.
La solidificazione è il passaggio dallo stato liquido allo stato solido (l'inverso della fusione); l'acqua di un bicchiere messa nel congelatore diventa solida e quindi è andata incontro al processo di solidificazione.
Durante la solidificazione di una sostanza pura, la temperatura del sistema rimane costante, ed è uguale alla temperatura di fusione.
Tale trasformazione avviene con cessione di calore ed è quindi un processo esotermico.
7. sublimazione
La sublimazione è il passaggio diretto dallo stato solido allo stato aeriforme. Sono poche le sostanze che possono possono sublimare; tra esse ricordiamo: lo iodio, la naftalina, la canfora e il ghiaccio secco.
Tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico.
8. brinamento
Il brinamento è il passaggio diretto dallo stato aeriforme allo stato solido e pertanto è il passaggio invero della sublimazione.
Un esempio di sostanza che può brinare è il vapore acqueo dell'atmosfera che, in determinate condizioni, può trasformarsi in aghetti di ghiaccio i quali si depositano sull'erba e sul terreno di un campo formando la brina.
La brina, che notiamo nelle mattine invernali sulle foglie degli alberi e nell'erba, è pertanto dovuta al brinamento del vapore acqueo ovvero al passaggio del vapore d'acqua contenuto nell'atmosfera direttamente a ghiaccio, nelle opportune condizioni di temperatura e pressione.
Tale trasformazione avviene con cessione di calore ed è quindi un processo esotermico.
Di seguito una rappresentazione schematica di tutti i passaggi di stato:
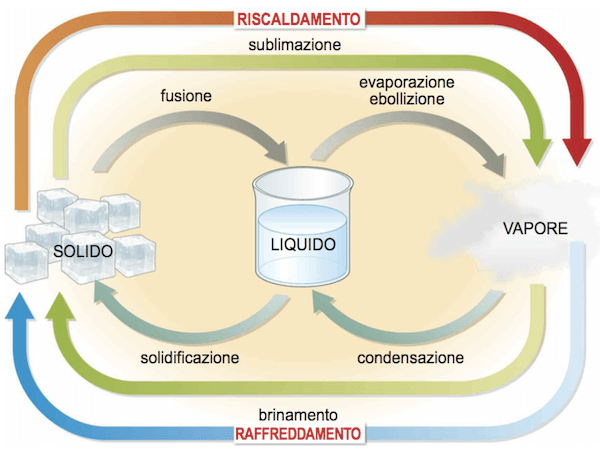
Passaggi di stato.
Ricordiamo infine che i passaggi di stato sono esempi di trasformazioni fisiche della materia, ovvero di trasformazioni reversibili della materia.
Studia con noi