Liquefazione
Passaggi di stato: la liquefazione
Per liquefazione si intende il passaggio di un corpo dallo stato gassoso allo stato liquido; tale trasformazione avviene con cessione di calore e quindi è un processo esotermico.
Quando un gas può essere liquefatto?
La liquefazione è un passaggio di stato che può avvenire per sola compressione solo se il gas si trova ad una temperatura inferiore alla sua temperatura critica. Al di sopra della temperatura critica un gas non può essere liquefatto per sola compressione e dovrà essere quindi necessariamente raffreddato, mentre al di sotto della temperatura critica un gas può essere liquefatto anche per sola compressione.
Nella figura seguente sono riportate, come tipico esempio di isoterme pressione-volume di un gas reale, alcune isoterme relative al biossido di carbonio.
Tali isoterme presentano due diversi andamenti a seconda che la temperatura cui si riferiscono sia al di sotto o al di sopra della temperatura critica del CO2 (tcr = 31,01°C), cioè a seconda che la specie gassosa sia o non sia liquefacibile per compressione.
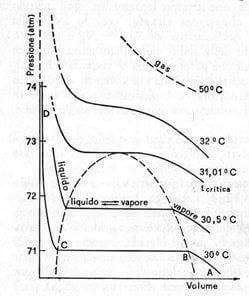
Isoterme P, V del diossido di carbonio: entro la curva a campana, ogni curva rappresenta un sistema liquido-vapore in equilibrio (vapore saturo).
Al di sopra della temperatura critica le isoterme hanno un andamento che si avvicina tanto più a quello di una iperbole (caso del gas ideale) quanto più elevata è la temperatura, mentre al di sotto si verifica liquefazione di CO2; come si evince dal grafico, a ciascuna temperatura uguale o inferiore alla temperatura critica la liquefazione avviene a una determinata pressione detta pressione critica.
Illustriamo, ad esempio, l'isoterma a 30°C: comprimendo con continuità il CO2, inizialmente la curva pressione-volume segue l'andamento AB, normale per un gas reale che viene compresso, e in B il CO2 comincia a liquefare; da questo punto (e fino a C) continuando a comprimere, il volume della fase gassosa continua a diminuire ma la pressione si mantiene costante (a 71 atm) perché il sistema è costituito da un liquido in presenza del suo vapore. In C tutto il CO2 è liquefatto e non esiste più CO2 vapore.
Continuando a comprimere, poiché il liquido CO2, come tutti i liquidi, è assai poco comprimibile, a piccolissime variazioni del volume corrispondono elevate variazioni della pressione.
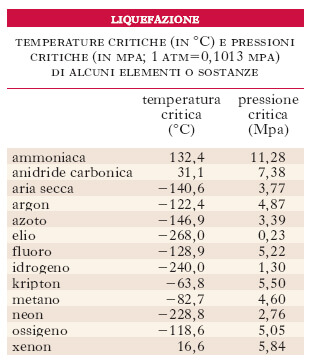
Temperature critiche e pressioni critiche di alcune sostanze.
Allo stesso modo, la temperatura critica dell'acqua corrisponde a circa 373,9°C. La liquefazione dell'acqua per sola compressione è possibile solo a temperature inferiori alla temperatura critica (e quindi per esempio a temperatura ambiente). A temperature superiori ai 373,9°C non è invece possibile liquefare l'acqua per sola compressione ma si dovrà anche raffreddarla e portarla ad una temperatura inferiore ai 373,9°C.
Calore latente di liquefazione
Come si è detto in precedenza, il processo di liquefazione è di tipo esotermico e quindi libera energia. Il calore liberato, a una data temperatura, nel processo di liquefazione di una mole di gas prende il nome di calore latente molare di liquefazione (λl) la cui unità di misura, nel Sistema Internazionale, è J·mol-1.
Noto λl, il calore liberato nella liquefazione di n moli di sostanza è determinabile applicando la seguente formula:
Q = n · λl
in cui:
λl = calore latente molare di liquefazione (J/mol);
n = numero di moli (mol).
Il calore di latente molare di liquefazione è numericamente uguale al calore latente molare di evaporazione ma di segno opposto.
Riassumendo
La liquefazione è il passaggio di un corpo dallo stato gassoso allo stato liquido. Il passaggio è favorito dalla compressione, ma il gas deve essere portato in ogni caso al di sotto della propria temperatura critica. La trasformazione ha luogo con cessione di calore ed è quindi un processo esotermico.
Quando tutto il gas è liquefatto, un aumento di pressione provoca una piccolissima diminuzione del volume del liquido.
Questo processo si può eseguire a tutte le temperature sino a quella critica e la curva che rappresenta la variazione del volume del componente che si comprime a temperatura costante con la pressione si chiama isoterma. Quella relativa alla temperatura critica si chiama isoterma critica; sopra di essa esiste la regione del solo gas e per temperature superiori non è possibile liquefare il gas per sola compressione.
Studia con noi