Ebollizione
Passaggi di stato: l'ebollizione
Per ebollizione si intende il passaggio rapido e tumultuoso di un corpo dallo stato liquido allo stato di vapore; a differenza dell'evaporazione che è un fenomeno limitato alle sole molecole distribuite sulla superficie libera del liquido, l'ebollizione interessa tutta la massa del liquido ed è caratterizzata dal formarsi di bolle, che, risalendo in superficie, sfuggono attraverso essa. Il processo di ebollizione avviene con acquisto di calore ed è quindi un processo endotermico.
Perché un liquido bolle?
Per rispondere alla domanda dobbiamo introdurre una grandezza nota come pressione o tensione di vapore.
La pressione di vapore è la pressione che un vapore esercita, ad una determinata temperatura, sulla superficie del suo liquido una volta raggiunto l'equilibrio liquido/vapore.
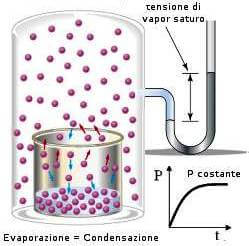
Raggiunto l'equilibrio liquido/vapore, ad una certa temperatura t, il vapore esercita sul suo liquido una pressione nota come pressione di vapore.
Riscaldando un liquido, la sua pressione di vapore aumenta sino a quando raggiunge un valore che eguaglia la pressione atmosferica. La temperatura corrispondente prende il nome di temperatura di ebollizione il cui valore dipende dalla pressione ambiente. Raggiunto questo stato il liquido inizia a bollire formando bolle di vapore (anche all'interno della massa del liquido) che, risalendo in superficie, sfuggono attraverso essa.
Alla temperatura di ebollizione corrisponde un'energia cinetica media delle particelle del liquido tale che possano sfuggire attraverso il liquido stesso.
In altre parole: aumentando la temperatura di un liquido l'energia cinetica media delle particelle che lo compongono è tale che la pressione di vapore del liquido raggiunge il valore della pressione che insiste sulla superficie del liquido stesso (pressione esterna) e il liquido inizia a bollire, cioè si ha formazione di vapore non soltanto alla superficie del liquido, ma in tutta la massa; la temperatura a cui ciò si verifica è detta temperatura di ebollizione, ed il suo valore, per uno stesso liquido, dipende dalla pressione esterna.
Inoltre, ogni piccolissima bolla di gas (per esempio di aria), aderente sul fondo o sulla parete del recipiente contenente il liquido che viene riscaldato, forma una superficie interna in seno alla massa del liquido, nella quale si raccolgono alcuni vapori della sostanza.
Se la pressione di questi vapori è uguale, o meglio è leggermente superiore a quella esterna che grava sulla superficie del liquido, dall'interno della sua massa salgono delle bolle di vapore, con il che si verifica l'ebollizione del liquido.
Da quanto detto risulta che per portare all'ebollizione un liquido si può quindi aumentare sufficientemente la sua temperatura o abbassare la pressione che grava su di esso. È per questo motivo che in alta montagna dove l'aria è più rarefatta e la pressione atmosferica è minore, l'acqua bolle ad una temperatura inferiore ai 100°C.
Un liquido quindi può bollire ad innumerevoli temperature, perché innumerevoli sono i valori che possono farsi assumere alla pressione esterna. Quando si parla di temperatura di ebollizione di un liquido senza definire la pressione, si intende, convenzionalmente, che la pressione esterna sia P = 1 atm.
Ebollizione e calore latente di ebollizione
Siamo abituati a pensare che fornendo calore ad una sostanza la sua temperatura aumenti. In realtà, durante l'ebollizione (ad esempio dell'acqua), la temperatura della sostanza che bolle rimane costante.
Il calore fornito in questa fase viene definito "latente" in quanto non provoca aumento della temperatura del liquido ma viene impiegato per indebolire le forze di coesione tra le particelle del liquido, permettendo loro di allontanarsi fino a passare allo stato di vapore.
Più in particolare, il calore latente di ebollizione è il calore necessario per provocare il cambiamento di stato dell'unità di massa del liquido alla sua temperatura di ebollizione.
Differenza tra ebollizione ed evaporazione
L'ebollizione non è da confondere con l'evaporazione. L'evaporazione è il passaggio di un liquido a vapore che avviene per temperature inferiori a quella di ebollizione e interessa soltanto le molecole distribuite sulla superficie libera del liquido.
L'ebollizione invece avviene ad una temperatura caratteristica (il cui valore dipende come detto dalla pressione esterna) detta temperatura di ebollizione; si ha il passaggio tumultuoso del liquido a vapore con formazione di bolle all'interno della massa del liquido.
Temperature di ebollizione di alcune sostanze
Ogni liquido ha una sua temperatura di ebollizione esattamente definita. Di seguito riportiamo le temperature di ebollizione di alcune importanti sostanze calcolate alla pressione di 1 atm:
Azoto = - 196°C
Ossigeno = -183°C
Metano = - 162°C
Alcol etilico = 78,5 °C
Acqua = 100°C
Sodio = 900°C
Sale da cucina = 1465 °C
Alluminio = 2519 °C
Stagno = 2602 °C
Oro = 2808 °C
Tungsteno = 5500 °C
Link correlati:
Quanto vale il calore latente dell'acqua?
Che cosa rappresenta la curva di raffreddamento di una sostanza pura?
Qual è la differenza tra evaporazione ed ebollizione?
Che cos'è il calore sensibile?
Che cosa si intende per durezza totale, durezza temporanea e durezza permanente di un'acqua?
Studia con noi