Legge di Lambert Beer
Enunciato e spiegazione della legge di Lambert Beer
La legge di Lambert-Beer (o più correttamente, legge di Bouguer-Lambert-Beer, dai nomi di coloro che si occuparono alla sua definizione; viene ricordata talvolta come legge di Beer perché fu lui che si occupò in particolare delle soluzioni) descrive i fenomeni di assorbimento di radiazioni elettromagnetiche e sta alla base dell'applicazione della spettrofotometria.
Supponiamo che una luce monocromatica di intensità I0 colpisca una soluzione contenuta all'interno di una cuvetta; sia I l'intensità del raggio che emerge dalla parte opposta.
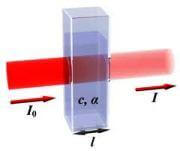
Possiamo definire una grandezza chiamata assorbanza come:
![]()
in cui T è un'altra grandezza chiamata trasmittanza.
Enunciato della legge di Beer
La legge di Lamber-Beer riguarda l'assorbanza e afferma che tale grandezza è direttamente proporzionale alla concentrazione della soluzione contenuta nella cuvetta:
![]()
Nell'equazione precedente, valida per radiazioni monocromatiche, si ha che:
- ε è l'assorbività molare o coefficiente di assorbimento molare, la cui unità di misura è M-1·cm-1 o in modo equivalente L · cm-1 · mol-1. È una grandezza che dipende dal tipo di solvente, dalla lunghezza d'onda utilizzata e dalla specie chimica che dà l'assorbimento; è indipendente invece dalla temperatura.
- l è il cammino ottico ovvero lo spessore della soluzione contenuta nella cuvetta e attraversato dalla luce; viene misurato in cm.
- C è la concentrazione della soluzione contenuta nella cuvetta; la sua unità di misura è M (M = mol/L)
La legge di Lambert-Beer è valida per soluzioni diluite la cui molarità M è inferiore a 0,01 mol/L.
Il cammino ottico (l) ed ε sono valori costanti: ricordando che il prodotto tra due valori costanti è un valore costante, l'equazione di Lambert-Beer può essere scritta anche nel seguente modo:
![]()
Questa è l'equazione di una retta che passa per l'origine il cui coefficiente angolare è rappresentato da k (k = ε · l) :
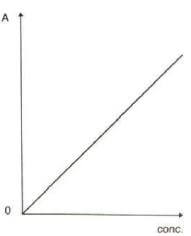
A volte però il grafico devia dalla linearità, a causa di una serie di fattori chimico-fisici, strumentali e operativi.
Deviazione della legge di Beer
Indichiamo alcuni dei più importanti fattori che possono determinare deviazione dalla linearità della legge di Beer.
1) All'aumentare della concentrazione della soluzione (soprattutto se questa è elevata) l'indice di rifrazione della soluzione può cambiare e questo comporta un variazione del valore di ε.
2) A concentrazioni elevate le molecole del soluto possono dare luogo a dimeri o a polimeri che assorbono diversamente dalla singola molecola.
3) L'aumento della concentrazione può comportare variazioni del pH della soluzione che a sua volta può comportare deviazione dalla linearità soprattutto nei casi di specie all'equilibrio con diverso ε.
4) Variazioni di temperatura, in modo particolare per reazioni all'equilibrio, possono comportare sensibili variazioni dell'assorbanza. Secondo il principio di Le Chatelier, infatti, una variazione della temperatura può comportare una variazione della concentrazione delle specie all'equilibrio.
5) Il solvente può influenzare la distribuzione elettronica delle molecole; perciò, a seconda della quantità di solvente presente, e quindi a seconda del grado di concentrazione della soluzione, se si mescolano molecole polari con solventi polari, si possono verificare apprezzabili variazioni dell'assorbimento della soluzione al variare della sua concentrazione.
6) La luce diffusa, dovuta a cause strumentali, può incidere sull'accuratezza dell'analisi.
7) Fattori operativi, quali ad esempio errori nelle pesate, cuvette sporche, perdita di sensibilità degli strumenti, possono influenzare, anche notevolmente, il valore dell'assorbanza della soluzione.
Esercizio
Il testosterone (un ormone appartenente alla categoria degli androgeni) assorbe a 244 nm.
Sapendo che a questa lunghezza d'onda il coefficiente di assorbimento molare del composto vale ε = 1,6 · 104 M-1·cm-1, si determini la concentrazione di una sua soluzione sapendo che fornisce un'assorbanza di 0,134 in una cella con un cammino ottico di 1 cm.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della concentrazione del testosterone in una soluzione che ad una determinata λ fornisce un'assorbanza di 0,134 in una cella con cammino ottico di 1 cm.
Applichiamo la legge di Lambert-Beer:
A = ε · l · C
in cui, nel nostro caso:
A = 0,134
ε = 1,6 · 104 M-1·cm-1
l = 1 cm
C = ?
Ricaviamo C:
C = A / (ε · l) = 0,134 / (1,6 · 104 ·1) = 8,37 · 10-6 mol/L
Link correlati:
Esercizi online e gratuiti sulla legge di Lambert-Beer
Esercizio svolto e commentato sul calcolo dell'assorbanza e della trasmittanza percentuale
Esercizio sul calcolo della concentrazione di un composto tramite la legge di Beer
Esercizi svolti e online sulla spettrofotometria di assorbimento atomico
Studia con noi