Calore latente
Calore latente di fusione e calore latente di vaporizzazione
La legge fondamentale della termologia ci insegna che fornendo (o sottraendo) calore Q ad un corpo di massa m, la sua temperatura si innalza (o si abbassa) passando da un valore iniziale t1 a un valore finale t2 secondo l'equazione:
Q = m · C · Δt
In cui:
Q è la quantità di calore scambiata (J)
m è la massa del corpo (kg)
Cs è il calore specifico del corpo J/(kg · K)
Δt è la differenza di temperatura t2 - t1 (K)
Questa legge però non è sempre valida; in particolare nei passaggi di stato (ebollizione, fusione, solidificazione, ecc.) fornendo (o sottraendo) calore la temperatura del corpo, a differenza di quanto detto in precedenza, rimane costante.
I passaggi di stato delle sostanze pure avvengono infatti a temperature ben precise e caratteristiche per ogni sostanza; queste temperature rimangono costanti per tutta la durata del processo.
Calore latente di fusione
Nel caso della fusione del ghiaccio, ad esempio, la temperatura resta costante per tutto il processo anche se il sistema continua ad assorbire energia dall'ambiente sotto forma di calore. Tale quantità di energia è chiamata calore latente di fusione.
Nel caso della fusione, il calore assorbito viene utilizzato per vincere le forze di coesione che mantengono le molecole fisse, vicine le une alle altre.
Calore latente di ebollizione
Come la fusione, anche l'ebollizione è un processo che richiede energia. Il calore latente di vaporizzazione (o di ebollizione), fornito durante l'ebollizione della sostanza, viene utilizzato per indebolire le forze di coesione tra le particelle del liquido, permettendo loro di allontanarsi fino a passare allo stato di vapore.
Latente significa "che non si vede" (dal latino latere, restare nascosto) perché, come detto in precedenza, l'assorbimento di calore non si manifesta con un aumento della temperatura.
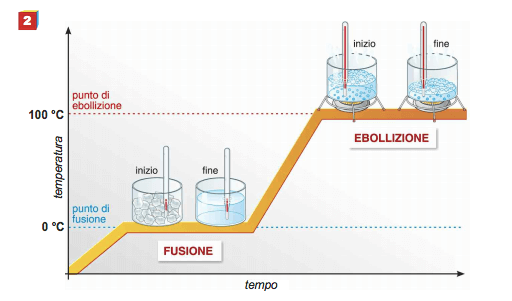
Curva di riscaldamento dell'acqua distillata: si nota che durante la fusione e durante l'ebollizione la temperatura rimane costante. Il calore fornito in questi passaggi di stato è definito latente.
Definizione di calore latente di fusione e di vaporizzazione
Il calore latente di fusione (λf) è la quantità di energia necessaria per fondere completamente 1 g di sostanza alla temperatura di fusione.
Considerando il passaggio dallo stato liquido allo stato di vapore, possiamo definire il calore latente di vaporizzazione (λv) come la quantità di energia necessaria per far evaporare completamente 1 grammo di sostanza alla temperatura di ebollizione.
Il calore latente di vaporizzazione e di fusione si misurano in joule su grammo di sostanza (J/g); sono proprietà intensive della materia e caratteristiche per ogni sostanza pura.
Tabella calori latenti di fusione e di ebollizione di alcune sostanze
Nella seguente tabella sono riportati i calori latenti di fusione di alcune sostanze:
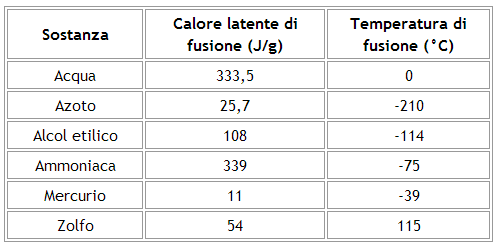
Calore latente di fusione di alcune sostanze.
Nella seguente tabella sono riportati i calori latenti di ebollizione di alcune sostanze:
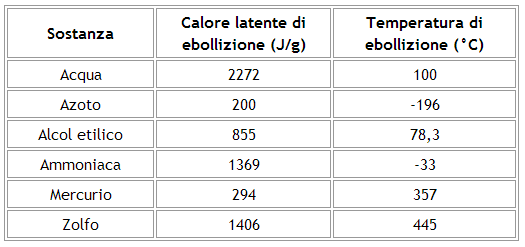
Calore latente di ebollizione di alcune sostanze.
Il calore necessario per la fusione di una quantità di sostanza di massa m è determinabile applicando la seguente formula:
Q = m · λf
in cui:
m = massa della sostanza (g)
λf = calore latente di fusione (J/g)
Q = quantità di calore assorbita (J)
Le cui formule inverse sono:
m = Q / λf
λf = Q / m
Il calore necessario per la vaporizzazione di una quantità di sostanza di massa m è determinabile applicando la seguente formula:
Q = m ·λv
in cui:
λv = calore latente di vaporizzazione (J/g)
Le cui formule inverse sono:
m = Q / λv
λv = Q / m
Esercizio #1
Svolgiamo un esempio per rendere più chiare le idee.
Supponiamo di volere determinare la quantità di calore necessaria per fondere un cubetto di ghiaccio di massa 120 g che si trova alla temperatura di 0°C. Si sappia che il calore latente di fusione del ghiaccio è pari a 333,5 J/g.
Svolgimento dell'esempio
Come detto in precedenza, il calore necessario per la fusione di una quantità di ghiaccio di massa m è determinabile applicando la seguente formula:
Q = m ·λf
in cui:
m = massa del ghiaccio (g)
λf = calore latente di fusione (J/g)
Q = quantità di calore assorbita (J)
Nel nostro caso:
m = 120 g
λf = 333,5 J/g
Q = ?
Sostituendo in modo opportuno i dati a nostra disposizione, si ha che:
Q = m · λf = 120 · 333,5 = 40.020 J
Pertanto per fondere 120 g di ghiaccio che si trovano alla temperatura di 0°C è necessario fornire una quantità di calore pari a 40.020 J.
Ciò significa che fornendo questa quantità di calore tutta l'acqua del cubetto passerà dallo stato solido allo stato liquido mantenendo sempre la temperatura di 0°C.
Se la quantità di calore che andremo a fornire sarà invece inferiore a 40.020 J allora solo una parte del ghiaccio fonderà, mentre la restante resterà solida.
Se la quantità di calore che andremo a fornire sarà invece superiore a 40.020 J non solo tutto il ghiaccio fonderà, ma con il calore in eccesso riscalderemo leggermente l'acqua sino ad una temperatura di poco superiore a 0°C.
Calori latenti e passaggi di stato
Ad ogni passaggio di stato corrisponde un proprio calore latente.
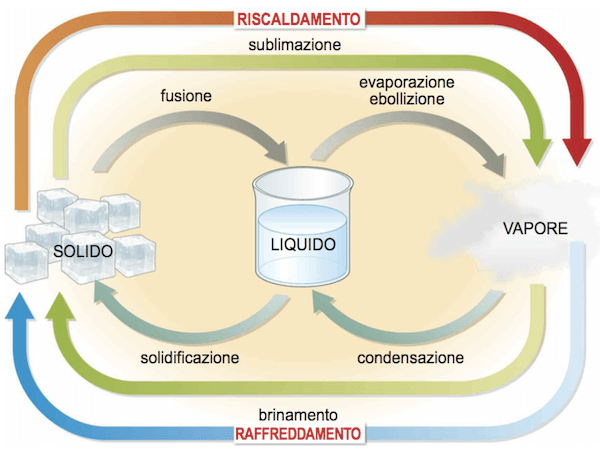
Passaggi di stato.
Per la fusione si ha il calore latente di fusione.
Per l'ebollizione (o evaporazione) si ha il calore latente di ebollizione (o di evaporazione).
Per la condensazione si ha il calore latente di condensazione; esso è numericamente uguale ma di segno opposto al calore latente di vaporizzazione.
Per la solidificazione si ha il calore latente di solidificazione; esso è numericamente uguale ma di segno opposto al calore latente di fusione.
Per la sublimazione si ha il calore latente di sublimazione.
Per il brinamento si ha il calore latente di brinamento; esso è numericamente uguale ma di segno opposto al calore latente di sublimazione.
Calore latente molare di fusione e di vaporizzazione
Nel caso in cui il calore latente venga espresso per mole di sostanza e non per grammo, si parla di calore latente molare di fusione e di calore latente molare di vaporizzazione.
Nel S.I. il calore latente molare è espresso in J/mol.
Per ulteriori info vedi anche: energia termica e passaggi di stato.
Esercizio #2 (livello di difficoltà elevato)
Un potente laser fornisce una potenza di 109 W e viene indirizzato contro una certa quantità di acqua che si trova alla temperatura di 30°C.
Sapendo che il laser spara 10 impulsi ognuno della durata di 10-8 s calcolare la massa di acqua che evapora.
Si sappia che il calore latente di vaporizzazione dell'acqua è 2,25∙106 J/kg.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sulla legge di Regnault.
Link correlati:
Quanto vale il calore latente dell'acqua?
Che cos'è il calore sensibile?
Che cos'è la curva di raffreddamento di una sostanza pura
Studia con noi