Fosforo bianco
Caratteristiche del fosforo bianco
Il fosforo elementare si presenta in sei diversi stati allotropici, dei quali tre sono i più noti: fosforo bianco, fosforo rosso e fosforo nero.
In questa sezione studieremo le caratteristiche e le principali proprietà del più importante tra i vari allotropi: il fosforo bianco.
Il fosforo bianco è un solido di aspetto ceroso, inodore, fonde a 44,15°C e bolle a 280,5°C.
Ha una densità di 1,823 g/cm3 e una massa molare di 123,89505 g/mol.
CAS number: 12185-10-3.
È solubile in solfuro di carbonio CS2 ed in molti solventi organici ed è estremamente tossico (provoca necrosi delle ossa).

Campione di fosforo bianco
Struttura del fosforo bianco
Il fosforo bianco è costituito da aggruppamenti di tetraedri P4 legati fra loro da forze di Van der Waals.
I tetraedri presentano tensioni interne (pari a circa 100 kJ/mol) e pertanto questa è la più reattiva delle forme allotropiche del fosforo.
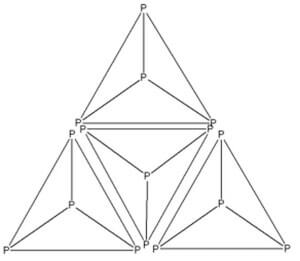
Struttura del fosforo bianco
La lunghezza di legame P-P è pari a 2,20 Å con angoli di legame P-P-P di 60°.
Reattività del fosforo bianco
A temperature maggiori di 40°C il fosforo bianco brucia con fiamma accesa. È per tale motivo che viene conservato sotto acqua.
Nel video seguente (non di nostra proprietà) viene mostrato il processo di autocombustione al quale il fosforo bianco va incontro.
Il fosforo bianco, conservato in acqua, viene appoggiato su un sostegno. Dopo pochi secondi il fosforo prende fuoco. La fiamma sprigionata è molto energica e raggiunge temperature molto elevate.
Sfruttando la reazione chimica di autocombustione alla quale va incontro, il fosforo bianco viene utilizzato come arma chimica (arma incendiaria) dagli effetti devastanti: a contatto con l'ossigeno dell'aria produce anidride fosforica secondo la reazione:
P4 + 5 O2 → 2 P2O5
La reazione è esotermica.
L'anidride fosforica prodotta, a contatto con tessuti organici (contenenti acqua) li disidrata producendo acido fosforico:
P2O5 + 3 H2O →H3PO4
Anche questa reazione è fortemente esotermica ed il calore sviluppato brucia il tessuto organico.
L'effetto complessivo è la totale distruzione del tessuto organico.
Metodo di produzione del fosforo bianco
Il fosforo bianco viene prodotto in un forno ad arco elettrico, riscaldando alla temperatura di 1450 °C una miscela formata da fosfato di calcio, carbone e silice (reazione di Wohler):
2 Ca3(PO4)2 + 10C + 6SiO2 → 6 CaSiO3 + 10 CO + P4
I vapori di fosforo sviluppati nella reazione chimica, vengono condensati e conservati (onde evitare l'ossidazione da parte dell'ossigeno dell'aria) sotto uno strato di acqua.
Usi del foforo bianco
Il fosforo bianco viene largamente impiegato oltre che nella produzione di armi chimiche anche nella preparazione dell'acido fosforico, dell'acido ipofosforoso e della fosfina.
Link correlati:
Che cosa sono le clorammine?
Come sono fatti i fiammiferi svedesi?
Che cos'è l'esafluoruro di zolfo?
Studia con noi