Fosforo rosso
Caratteristiche del fosforo rosso
Il fosforo elementare si presenta in sei diversi stati allotropici, dei quali tre sono i più noti: fosforo bianco, fosforo rosso e fosforo nero.
In questa sezione studieremo le caratteristiche e le principali proprietà del fosforo rosso.
Il fosforo rosso viene ottenuto dal fosforo bianco riscaldato a circa 400°C in presenza di catalizzatori (I2 , Na).
Ha una struttura che può considerarsi derivata da quella del fosforo bianco per rottura di un legame P-P del tetraedro P4 e successiva polimerizzazione per formazione di legami P-P fra tetraedri adiacenti.
Tale trasformazione implica che i legami fra le molecole P4 si trasformino da deboli legami di Van der Waals nel fosforo bianco a più forti legami covalenti nel fosforo rosso.
Ciò è ben sottolineato dai valori delle temperature di fusione delle due forme: 44,1°C per il fosforo bianco, circa 590°C (a 43 atm di pressione) per il fosforo rosso.
L'immagine seguente riassume quanto descritto:
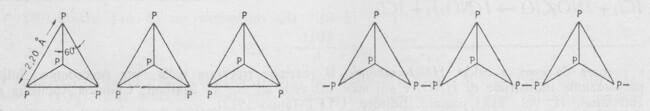
A sinistra: struttura del fosforo bianco. A destra: struttura del fosforo rosso.
Il fosforo rosso è quindi più stabile del fosforo bianco ma può comunque esplodere se mescolato con sostanze comburenti.
Il fosforo rosso è pulverulento; è insolubile in solfuro di carbonio e non è tossico.

Campione di fosforo rosso
A causa di successive trasformazioni allotropiche non esistono temperature ben definite di fusione e di ebollizione del fosforo rosso.
Usi del fosforo rosso
Il fosforo rosso trova impieghi nella fabbricazione di fiammiferi, in metallurgia come disossidante e nella preparazione di svariati composti del fosforo.
Viene utilizzato anche nella produzione dell'acido iodidrico. Si opera nel seguente modo: a 100 parti di iodio inumidito con 10 parti di acqua, si aggiungono poco alla volta 5 parti di fosforo rosso spappolato in 10 parti di acqua. Si forma dapprima pentaioduro di fosforo, PI5, che ben presto si scinde idroliticamente in acido fosforico ed acido iodidrico:
PI5 + 4 H2O → H3PO4 + 5 HI
Link correlati:
Come sono fatti i fiammiferi svedesi?
Studia con noi