Anidride fosforica
Proprietà e caratteristiche dell'anidride fosforica
L'anidride fosforica è un composto binario con formula chimica P2O5.
La formula P2O5 con la quale viene ancora oggi indicata l'anidride fosforica è in realtà la formula minima del decaossido di tetrafosforo:
P4O10 → 2 P2O5
che si ottiene bruciando il fosforo in un ambiente ricco di ossigeno:
P4 + 5 O2 → P4O10
In P4O10 il fosforo ha numero di ossidazione +5.
L'anidride fosforica è avidissima di acqua e combinandosi con essa può dare origine a tre acidi diversi a seconda della quantità di acqua con la quale si combina:
P2O5 + H2O → 2 HPO3 (acido metafosforico)
P2O5 + 2 H2O → 2 H4P2O7 (acido pirofosforico)
P2O5 + 3 H2O → 2 H3PO4 (acido ortofosforico)
Al di sotto dei 100°C P2O5 è un fortissimo disidratante e riesce a togliere H2O anche a molecole di acido nitrico, di acido solforico, formando acido metafosforico e, rispettivamente N2O5 ed SO3:
4 HNO3 + P4O10 → 4 HPO3 + N2O5
2 H2SO4 + P4O10 → 4 HPO3 + 2 SO3
Strutture dell'anidride fosforica

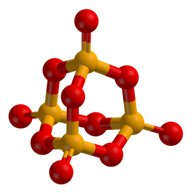
Modificazioni dell'anidride fosforica
L'anidride fosforica si presenta sotto forma di diverse modificazioni: allo stato solido, sotto forma cristallina amorfa o vetrosa, ed in quello liquido.
Sono note tre modificazioni cristalline:
1) Forma H o α: appartiene alla classe romboedrica del sistema esagonale, si presenta in lamelle esagonali, è volatile e metastabile.
È la modificazione più nota; è stabile a temperatura ambiente. L'analisi ai raggi X ha dimostrato che è formata da molecole semplici P4O10.
Nella loro struttura è possibile distinguere la disposizione degli atomi di fosforo ai vertici di un tetraedro. Ciascun atomo di fosforo è simmetricamente circondato da quattro atomi d'ossigeno disposti anch'essi ai vertici di un tetraedro; tre di questi atomi di ossigeno sono rispettivamente condivisi con gli altri atomi di fosforo.
Il punto di fusione di questa modificazione è 420°C; si ottiene operando con particolari precauzioni, poiché ad alta temperatura tende a polimerizzare.
2) Forma O: appartiene al sistema rombico; è metastabile. Si presenta normalmente come un aggregato di piccoli cristalli. Si ottiene per riscaldamento della modificazione precedente sino a 400°C.
La sua struttura è rappresentata da infiniti strati di tetraedri PO4, in cui tre degli atomi di ossigeno sono condivisi con altri tetraedri. Il punto di fusione è compreso fra 550-570°C, forse in corrispondenza di due diverse fasi liquide.
3) Forma T, O', δ: appartiene al sistema rombico; è stabile entro l'intervallo fra 70-580°C. Si presenta come un aggregato di grossi cristalli. Si ottiene riscaldando le due modificazioni precedenti a 450°C per 24 ore. Punto di fusione 580°C; fonde molto lentamente.
Allo stato di vapore, qualunque sia la modificazione solida presente, il pentossido di fosforo si trova sotto forma di molecole P4O10; la loro struttura è analoga a quella descritta per la forma H.
I vapori, per condensazione, danno origine alla forma H e, operando in condizioni adatte, ad una forma solida amorfa, detta forma β.
Sono note due modificazioni liquide. Una ottenuta per fusione della forma T che condensa in una forma vetrosa indicata come forma H. L'altra ottenuta per fusione della forma esagonale che condensa nella forma O oppure che può essere sopraraffreddata in una forma vetrosa.
Caratteristiche chimiche dell'anidride fosforica
Tutte le modificazioni dell'anidride fosforica reagiscono con l'acqua ma con una velocità diversa. La forma esagonale si dissolve in acqua con grande violenza e forte sviluppo di calore, la forma O si scioglie lentamente anche all'ebollizione, mentre la forma T gelatinizza a contatto dell'acqua con svolgimento di calore. Anche le forme vetrose reagiscono lentamente.
In presenza di un eccesso d'acqua tutte le forme tendono a dare, con velocità maggiore o minore, acido fosforico ; in difetto d'acqua si ottengono vari acidi fosforici condensati.
La forma esagonale, idratata normalmente, forma rapidamente acido fosforico: operando a freddo con precauzione si ottiene dapprima acido tetrametafosforico che per ulteriore idratazione si trasforma in seguito in fosforico.
Con l'acido cloridrico, fluoridrico, bromidrico e con i corrispondenti alogenuri di sodio e di calcio l'anidride fosforica reagisce formando acido metafosforico (HPO3) ed alogenuro di fosforo, soprattutto ossialogenuri: così, ad esempio, con l'acido fluoridrico:
2 P2O5 + 3 HF → 3 HPO3 + POF3
Preparazione dell'anidride fosforica
L'anidride fosforica si prepara di solito, sia in laboratorio che su scala industriale, per ossidazione con ossigeno oppure aria di un eccesso di fosforo. La reazione di ossidazione è:
2 P2 + 5 O2 → 2 P2O5
L'impianto industriale è formato da una camera di combustione dove di svolge l'ossidazione e da una vasta camera di condensazione dell'anidride fosforica, raffreddata esternamente con aria od acqua. Si ottiene essenzialmente la modificazione esagonale.
Un tempo l'anidride fosforica era anche ottenuta direttamente dai forni elettrici o dai forni a tino per fosforo, operando in ambiente ossidante.
Usi dell'anidride fosforica
L'anidride fosforica è impiegata principalmente come disidratante e trova numerose applicazioni industriali.
Può servire come materia prima per la preparazione di alcuni esteri del fosforo.
Studia con noi