Acetone
Proprietà e caratteristiche dell'acetone
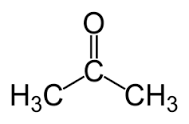
L'acetone, noto anche come dimetilchetone, propanone o anche come 2-ossopropano, è un composto chimico con fomula CH3-CO-CH3.
Appartiene alla famiglia dei chetoni; presenta la seguente struttura:
Noto probabilmente agli alchimisti arabi, l'acetone fu descritto da Libavius nella sua Alchymia (1595), quale prodotto della distillazione secca dell'acetato di piombo (Spiritus subtilis). La sua composizione chimica venne stabilita da Dumas.
L'acetone è un liquido incolore, infiammabile e di odore caratteristico; bolle a 56,2°C e fonde a -95,4°C.
I limiti di esplosione delle miscele vapori di acetone-aria sono 1,6% e 15,3%.
L'acetone si mescola con l'acqua, l'alcol etilico e l'etere in tutti i rapporti; forma azeotropi con l'alcol metilico, il cloroformio e il solfuro di carbonio.
L'acetone è un composto dotato di grande attività chimica e si presta a numerose trasformazioni, di cui alcune anche d'importanza industriale.

Bottiglia di acetone in vetro ambrato
Preparazione dell'acetone
Lo sviluppo della preparazione tecnica dell'acetone è uno degli esempi più chiari dell'influenza determinante del rapido modificarsi della classica industria chimica col sorgere della petrolchimica.
Fino alla fine della prima guerra mondiale la quasi totalità dell'acetone veniva preparata nell'industria per distillazione secca dell'acetato di calcio greggio ottenuto dall'acido pirolegnoso e calce.
Durante la prima guerra mondiale in Inghilterra fu sviluppato il processo fermentativo che però non ha mai avuto ampio sviluppo.
Subito dopo la prima guerra mondiale fu messo a punto in Germania il processo di decomposizione catalitica dell'acido acetico, fondato sulla reazione di Squibb:
2 CH3COOH → CH3-CO-CH3 + H2O + CO2
Poiché l'acido acetico si otteneva allora dall'acetilene, attraverso l'aldeide acetica, era questo un processo sintetico destinato ad un ampio sviluppo; infatti esso si diffuse in Europa (Francia, Germania) e nel Canada.
Da oramai diversi anni l'acetone è un prodotto della petrolchimica: esso viene ottenuto principalmente per deidrogenazione dell'alcool isopropilico.
Mentre nell'industria organica classica l'acetone costituiva la materia prima per la preparazione dell'alcool isopropilico, l'industria della petrolchimica ha rovesciato la posizione e ora l'alcool isopropilico è impiegato per la preparazione dell'acetone.
Negli USA la quasi totalità dell'acetone è ottenuta dall'alcool isopropilico per deidrogenazione ed ossidazione catalitica.
La deidrogenazione dell'alcool isopropilico è endotermica, quella di ossidazione esotermica, come risulta dalle seguenti equazioni chimiche:
CH3-CH(OH)-CH3 → CH3-CO-CH3 + H2 - 10,6 kcal
CH3-CH(OH)-CH3 + ½ O2 → CH3-CO-CH3 + H2O + 47,2 kcal
Abbinando le due reazioni, in modo da avere un processo autotermico (con ossigeno in difetto), si può avere il vantaggio di una minor spesa d'impianto rispetto al solo processo di deidrogenazione, il quale però consente di recuperare circa 400 L di idrogeno per kg di acetone prodotto.
Nella produzione dell'acetone tramite deidrogenazione catalitica in fase vapore dell'alcol isopropilico, vengono utilizzati diversi catalizzatori fra cui il rame, il nickel Raney e l'ossido di zinco a temperature che variano da 150°C a 500 °C.
Ingenti quantità di acetone vengono anche ottenute come sottoprodotto nella sintesi del fenolo dal cumene (ossidazione acida del cumene).
Usi dell'acetone
L'acetone è un prodotto industriale di importanza fondamentale; la produzione annuale negli Stati Uniti è di circa 1 milione di tonnellate.
Gli usi più importanti dell'acetone sono la conversione in metilisobutilchetone, in 4-metil-2-pentanolo, in metacrilato di metile e in bisfenolo A.
L'applicazione come solvente dell'acetone comprende l'industria delle vernici, delle lacche e dell'acetato di cellulosa.
Link correlati:
Qual è la differenza tra aldeidi e chetoni?
Studia con noi