Proprietà solventi dell'acqua
Proprietà solventi dell'acqua nei confronti di sostanze polari, ioniche o elettricamente cariche
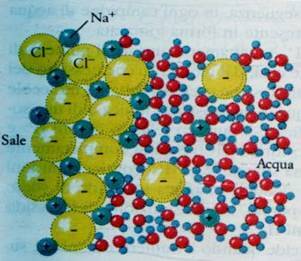
La polarità delle molecole dell'acqua è responsabile della capacità dell'acqua di comportarsi come solvente nei confronti di sostanze polari, ioniche o elettricamente cariche, ossia di interagire con le molecole di una sostanza (il soluto) separandole le une dalle altre, provocando una loro dispersione tra le proprie molecole e creando con esse legami di tipo elettrostatico.
Le sostanze che possono essere sciolte dall'acqua dunque sono:
- composti ionici (NaCl, KCl, etc...) ove l'attrazione esercitata dalle molecole d'acqua spezza i legami ionici e dà luogo agli ioni solvatati della sostanza (Na+, Cl−, K+, etc.),
- gas come l'ossigeno, l'anidride carbonica, l'ammoniaca vi si disciolgono bene;
- molecole unite da legami covalenti polari che si ionizzano, spesso comportandosi da acidi (aumentando la concentrazione di ioni H+) o basi (aumentando la concentrazione di ioni OH−);
- sostanze organiche dotate di gruppi polari come gli alcooli (-OH), gli acidi carbossilici (-COOH) e gli zuccheri;
- molecole complesse dotate di una parte idrofila ed una idrofoba che si disperdono formando aggregati micellari.
La presenza di soluti modifica le proprietà dell'acqua:
- innalzamento del punto di ebollizione
- diminuzione del punto di congelamento
- variazione della pressione osmotica
Link correlati:
Siamo sicuri che l'acqua frizzante non faccia ingrassare?
Studia con noi