Proprietà dell'acqua
Principali proprietà dell'acqua
L'acqua è il composto più diffuso in natura: tre quarti della superficie terrestre sono ricoperti da acqua, sotto forma di mari, oceani, fiumi, laghi, ghiacciai, etc..
L'acqua inoltre costituisce dal 50% al 95% del peso di ogni sistema vivente: nell'organismo umano ben il 60-70% in peso è costituito da acqua (si veda: acqua nel corpo umano).
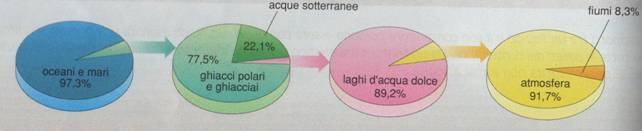
Da un punto di vista alimentare, essa dunque riveste un ruolo fondamentale non solo qualitativamente, ma anche solo quantitativamente.
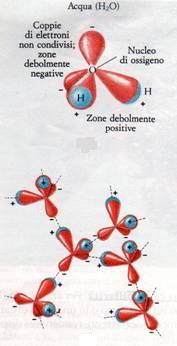
La molecola d'acqua è costituita da un atomo di ossigeno legato covalentemente a due atomi di idrogeno (H2O).
La forte differenza di elettronegatività tra le due specie di atomi determina una diseguale localizzazione delle cariche, ossia gli elettroni messi in comune tra O e H sono maggiormente attratti dall'O cosicché la molecola, pur rimanendo complessivamente neutra (n° elettroni = n° protoni), presenta proprietà polari.
La regione vicina al nucleo di idrogeno è infatti debolmente positiva, mentre quella del nucleo di ossigeno (ove tra l'altro sono presenti altri due doppietti di elettroni non coinvolti nel legame covalente), è debolmente carica negativamente.
Naturalmente ciò influisce su molte caratteristiche microscopiche e macroscopiche dell'acqua, prime fra tutte la geometria delle molecole e le modalità di aggregazione tra le molecole: la molecola d'acqua, in termini di polarità, presenta quattro vertici di cui due negativi (doppieti non coinvolti nel legame covalente) e due positivi (atomi di idrogeno), ma l'angolo tra gli H non è di 109° come avverrebbe in un tetraedro regolare, bensì di 104.5° per motivi di interazione elettrostatica.
Inoltre i vertici costituiti dagli H di una molecola tendono, sempre per interazione elettrostatica, ad attrarre i vertici costituiti dall'O delle molecole circostanti cosicché si forma un legame relativamente forte tra le molecole: il legame o ponte a idrogeno.
La polarità della molecola e la presenza di numerosi legami a idrogeno determinano le peculiari caratteristiche chimico-fisiche dell'acqua:
Elevati punto di fusione (0 °C), punto di ebollizione (100 °C), calore specifico (1 cal/g°C) e calore latente di evaporazione (596 cal/g a 0 °C e 540 cal/g a 100 °C), da cui l'esistenza dell'acqua allo stato liquido in condizioni ambiente e la sua resistenza ai cambiamenti di temperatura così importanti per la termoregolazione e le funzioni vitali degli organismi viventi; anche queste proprietà dipendono direttamente dal legame a idrogeno che mantiene assieme le molecole di acqua e tende ad ostacolare il loro movimento, ossia a contenere la loro energia cinetica direttamente legata alla temperatura del liquido.
Altre proprietà dell'acqua
Inoltre vengono discusse le seguenti proprietà dell'acqua:
tensione superficiale e capillarità dell'acqua
anomalo comportamento della densità: il ghiaccio
Link correlati:
Siamo sicuri che l'acqua frizzante non faccia ingrassare?
Che cosa si intende per durezza totale, durezza temporanea e durezza permanente di un'acqua?
Di cosa si occupa l'idrologia medica?
Studia con noi