Acidi Carbossilici
Generalità e proprietà degli acidi carbossilici
Gli acidi carbossilici sono acidi organici caratterizzati dalla presenza del gruppo carbossilico (—COOH).
Molti di questi acidi furono isolati per la prima volta dai grassi e perciò talvolta vengono indicati con il termine di acidi grassi.
Nomenclatura degli acidi carbossilici
Nella nomenclatura IUPAC degli acidi carbossilici, bisogna inizialmente individuare la catena più lunga contenente il carbonio carbossilico.
Il suffisso -o dell'alcano corrispondente viene sostituito dal suffisso -oico e si premette la parola acido.
Se il gruppo -COOH è legato ad un ciclo, l'acido può essere nominato usando il suffisso -carbossilico.
Ad esempio:
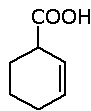
Il composto si chiama: acido 2-cicloesencarbossilico.
Sono ancora utilizzati però i nomi tradizionali, derivanti di solito da parole latine o greche che ne indicano la fonte originale.
I primi dieci termini della serie degli acidi carbossilici a catena non ramificata sono riportati nella tabella seguente:
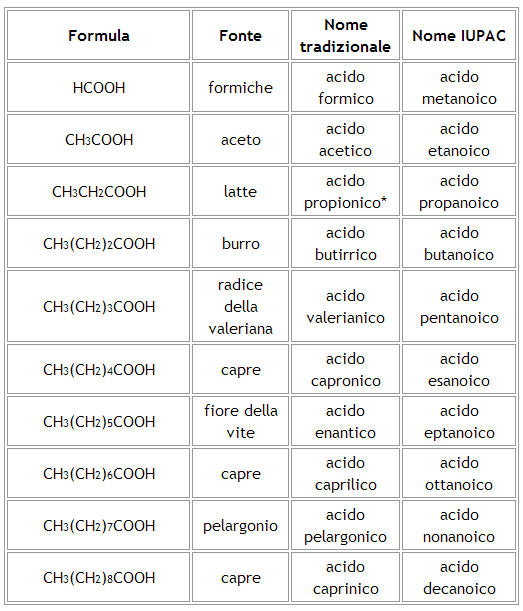
* = dal greco, protós píon, primo grasso.
Per la nomenclatura IUPAC degli acidi carbossilici sostituiti, la catena viene numerata in modo tale da dare al carbonio carbossilico il numero più basso possibile.
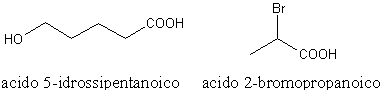
Nella nomenclatura tradizionale degli acidi carbossilici sostituiti, invece, la posizione dei sostituenti viene indicata con le lettere greche (α = alfa, β = beta, γ = gamma, δ = delta) partendo però dall'atomo di carbonio adiacente al carbonio carbossilico.
Pertanto gli acidi precedenti avranno i seguenti nomi:
acido δ-idrossipentanoico
e
acido α-bromopropanoico
Caratteristiche
Gli acidi carbossilici sono composti polari che possono legarsi facilmente in coppie formando legami a idrogeno tra il carbonile di un acido e l'ossidrile dell'altro e viceversa:
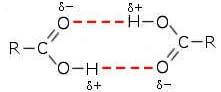
Come conseguenza gli acidi carbossilici hanno punti di ebollizione piuttosto elevati, ancor più elevati, a parità di massa molecolare, dei corrispondenti alcoli. Ad esempio, l'acido acetico e l'alcol n-propilico hanno la stessa massa molecolare (60 u) ma bollono rispettivamente a 118°C e 97°C.
L'acidità degli acidi carbossilici
In soluzione acquosa gli acidi carbossilici si dissociano per formare un anione carbossilato (RCOO−) ed un idrogenione (H+) secondo il seguente equilibrio:
RCOOH ⇄ RCOO− + H+
La spiccata acidità degli acidi carbossilici è dovuta a due fattori: l'effetto di risonanza e l'effetto induttivo.
Effetto di risonanza
Se confrontiamo l'acidità dell'acido acetico (CH3COOH) con quella dell'etanolo (CH3CH2OH), notiamo che il primo è cento miliardi di volte più acido dell'etanolo:
CH3COOH ⇄ CH3COO− + H+ (Ka= 10-5)
CH3CH2OH ⇄ CH3CH2O− + H+ (Ka= 10-16)
Nello ione etilato (CH3CH2O−) infatti la carica negativa è localizzata sull'atomo di ossigeno, mentre nello ione acetato (CH3COO−) la carica negativa è delocalizzata per effetto di risonanza tra i due atomi di ossigeno:
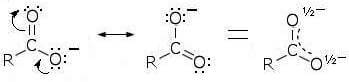
Lo ione acetato viene così stabilizzato per risonanza e ciò lo rende particolarmente stabile. Pertanto l'equilibrio dell'equazione chimica:
CH3COOH ⇄ CH3COO− + H+
è più spostato a destra rispetto a quello dell'equazione
CH3CH2OH ⇄ CH3CH2O− + H+
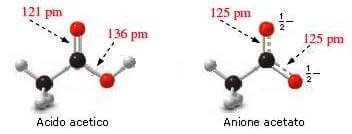
I dati fisici confermano la risonanza dello ione acetato. Nell'acido acetico infatti i due legami carbonio-ossigeno hanno lunghezze diverse, mentre nello ione acetato entrambi i legami carbonio-ossigeno sono identici e la loro lunghezza ha un valore intermedio tra quella di un singolo e quella di un doppio legame carbonio-ossigeno:
Effetto induttivo
Un fattore molto importante che determina variazioni anche notevoli nel valore dell'acidità degli acidi carbossilici, è il tipo di gruppo legato al carbossile: i gruppi elettronattrattori determinano un aumento di acidità mentre i gruppi elettrondonatori la fanno diminuire.
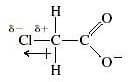
Prendiamo come esempio l'acido cloro-acetico: il cloro legato al carbonio in α (alfa) al gruppo carbossilico, essendo un elemento molto elettronegativo, ha un effetto elettronattrattore che stabilizza lo ione cloroacetato:
Viceversa, i gruppi alchilici (–CH3) sono debolmente elettronrepulsori e quindi accentuano la carica negativa sugli ossigeni dello ione carbossilato e determinano quindi una diminuzione di acidità. Per tale motivo l'acido acetico (CH3COOH) è circa 12 volte più debole dell'acido formico (HCOOH).
Gli acidi che presentano invece due gruppi carbossilici sono chiamati acidi bicarbossilici.
Esercizi sugli acidi carbossilici
Li trovi al seguente link: esercizi sugli acidi carbossilici.
Se sei invece interessato ad un software che permette di disegnare le molecole, allora vai alla seguente pagina: come si usa ChemSketch.
Link correlati:
Qual è l'acido trifluoroacetico?
Qual è la differenza tra acidi grassi saturi e insaturi?
Studia con noi