Calore specifico acqua
Quanto vale il calore specifico dell'acqua?
Il calore specifico dell'acqua corrisponde alla quantità di energia assorbita (o ceduta) da 1 grammo di acqua durante un aumento (o una diminuzione) di temperatura di 1°C (o in modo equivalente di 1K).
Ma quanto vale il calore specifico dell'acqua?
Il calore specifico può essere espresso sia in J/(g ·°C) che in cal/(g ·°C).
Se il calore specifico dell'acqua viene espresso in J/(g ·°C), esso vale:
Cs = 4,18 J / (g ·°C)
Se il calore specifico dell'acqua viene espresso in cal/(g ·°C), esso vale:
Cs = 1,00 cal / (g ·°C)
Pertanto, in base alla definizione di calore specifico dell'acqua, possiamo affermare che, se misuriamo la quantità di calore necessaria per aumentare la temperatura di 1 grammo di acqua di 1°C, vedremo che essa è pari a 4,18 J ovvero 1,00 cal.
Ricordando inoltre che la variazione di temperatura di 1°C corrisponde alla variazione di temperatura di 1K (sono entrambe scale centigrade), possiamo esprimere il calore specifico dell'acqua anche nelle seguenti unità di misura, che impiegano il kelvin anziché il grado Celsius come unità di misura della temperatura:
Cs = 4,18 J / (g ·K)
Cs = 1,00 cal / (g ·K)
Altre unità di misura del calore specifico sono:
Cs = 4,18 KJ / (kg ·°C)
Cs = 1,00 Kcal / (kg ·°C)
Cs = 4,18 KJ / (kg ·K)
Cs = 1,00 Kcal / (kg ·K)
Considerazioni sul valore del calore specifico dell'acqua
Nella seguente tabella sono riportati i calori specifici di alcuni materiali:
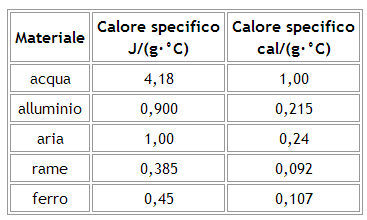
Come è possibile notare, il calore specifico dell'acqua è particolarmente elevato: ciò significa che, nel caso dell'acqua, occorre molta energia per ottenere piccoli incrementi di temperatura.
Grazie a questa sua proprietà, l'acqua dei grandi bacini, laghi e mari, si comporta come un grande "serbatoio termico", accumulando durante il giorno grandi quantità di calore e rilasciandole la notte. In questo modo l'acqua è responsabile del clima mite che si ha in molte zone in cui sono presenti grandi quantità di acqua.
Calore specifico dell'acqua e legge fondamentale della termologia
Il valore del calore specifico dell'acqua può essere impiegato per calcolare la quantità di calore necessaria per aumentare, di un determinato valore, la temperatura di una certa massa di acqua.
Supponiamo, ad esempio, di volere calcolare la quantità di calore necessaria per aumentare la temperatura di 100 grammi di acqua da 20°C a 30°C.
La formula della legge fondamentale della termologia ci permette questo calcolo:
![]()
in essa:
Q = quantità di calore
m = massa dell'acqua
Cs = calore specifico dell'acqua
Δt = t2 - t1 = variazione di temperatura
Nel nostro caso:
Q = ?
m = 100 g
Cs = 1,00 cal / (g ·°C)
Δt = 30 - 20 = 10°C
Sostituendo in modo opportuno si ha che:
Q = 100 · 1,00 · 10 = 1000 cal
Pertanto sono necessarie 1.000 calorie per aumentare di 10°C la temperatura di 100 grammi di acqua.
Allo stesso modo avremmo potuto calcolare la quantità di calore in joule semplicemente usando come valore del calore specifico dell'acqua 4,18 J / (g ·°C).
Link correlati:
Qual è l'unità di misura del calore specifico?
Quali sono le proprietà fisiche e chimiche dell'acqua?
A cosa sono dovute le proprietà solventi dell'acqua?
Quanto vale il calore specifico dell'olio?
Studia con noi