Pressione osmotica ed equazione di Van't Hoff
Pressione osmotica ed equazione di Van't Hoff. Come calcolare il valore della pressione osmotica
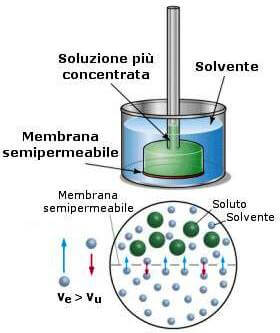
Si è riscontrato sperimentalmente che ponendo in contatto un solvente puro e una sua soluzione attraverso una membrana che consenta il passaggio soltanto alle molecole di solvente (membrana semipermeabile), si verifica uno spostamento di molecole dal solvente alla soluzione.
Questo processo viene definito osmosi.
La membrana semipermeabile separa il solvente puro dalla soluzione e ha la caratteristica di lasciare passare le molecole del solvente, ma non quelle del soluto.
Soltanto le molecole del solvente attraversano la membrana nei due sensi; inizialmente però, è di gran lunga prevalente il passaggio dal solvente puro alla soluzione (si veda figura seguente).
Dalla parte del solvente puro, infatti, le particelle che vengono a contatto della membrana sono tutte di solvente, mentre dalla parte della soluzione vengono a contatto sia le molecole del solvente sia quelle del soluto e queste ultime non attraversano la membrana.
Il solvente tende quindi gradualmente a diluire la soluzione fino a che non si stabilisce un equilibrio di concentrazione.
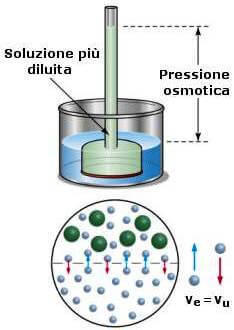
Nel caso delle soluzioni acquose questo si verifica quando nella soluzione l'eccesso di acqua penetrata crea una pressione idrostatica, chiamata pressione osmotica, che tende a opporsi all'ulteriore passaggio di solvente.
In queste condizioni la diffusione delle molecole del solvente è uguale nei due sensi.
Definizione di pressione osmotica
Si definisce pertanto pressione osmotica (π) la pressione idrostatica necessaria a impedire lo spostamento di un solvente puro in una sua soluzione attraverso una membrana semipermeabile.
Equazione di Van't Hoff
J.H. Van't Hoff ha determinato sperimentalmente il valore della pressione osmotica nel caso di soluzioni diluite di non elettroliti. Risulta che:
![]()
dove:
- π = pressione osmotica (atm);
- V = volume della soluzione (L)
- n = numero di moli del soluto (mol)
- R = costante universale dei gas = 0,0821 (L·atm) / (mol·K)
- T = temperatura (K)
Tale equazione prende il nome di equazione di Van't Hoff.
Ricordando che la molarità M è data da:
![]()
si ha che:
![]()
Se la sostanza disciolta è invece un elettrolita e quindi dissociata in ioni, bisogna introdurre il coefficiente i di Van't Hoff. Esso vale 2, 3, 4, .... a seconda del numero di ioni in cui l'elettrolita è dissociato. Si ha rispettivamente:
![]()
e
![]()
Per esempio:
nel caso del solfato di sodio (Na2SO4 → 2Na+ + SO42−) i = 3, infatti nella dissociazione si vengono a formare in totale tre ioni (Na+ + Na+ + SO42−);
nel caso dell'acido cloridrico (HCl → H+ + Cl−) i = 2.
Si dicono isotoniche due soluzioni aventi la stessa pressione osmotica. Se due soluzioni hanno diversa pressione osmotica, quella a pressione osmotica minore viene detta ipotonica rispetto all'altra, che si dirà invece ipertonica.
Esercizio
Determinare la pressione osmotica (π ) a 35 °C di una soluzione del volume di 1,00 L contenente 12,0 grammi di glucosio (Mm = 180 g/mol).
Determiniamo il numero delle moli di glucosio:
nglucosio = gglucosio / Mm = 12,0 / 180 = 0,0667 mol
quindi la molarità:
M = nglucosio / Vsoluzione = 0,0667 / 1,00 = 0,0667 mol/L
Convertiamo la temperatura in kelvin:
T = 35 + 273 = 308 K
Calcoliamo il valore della pressione osmotica:
π = M · R · T = 0,0667 · 0,0821 · 308 = 1,686 atm
Esercizio
Fra le proprietà colligative, la pressione osmotica è quella che meglio si presta alla determinazione sperimentale della massa molecolare.
2,72 grammi di una proteina sono sciolti in acqua e portati a 100 mL. La soluzione ha una pressione osmotica π di 0,022 atm a 25 °C. Calcolare la massa molecolare della proteina.
Convertiamo la temperatura in kelvin:
25 + 273 = 298 K
Sapendo che:
π = M · R · T
ricaviamo la molarità:
M = π / (R·T) = 0,022 / (0,0821·298) = 9·10-4 mol/L
ricordando che 100 mL = 0,1 L (per info si veda: 100 mL in litri), determiniamo il numero delle moli della proteina:
nproteina = M · V = 9·10-4 · 0,1 L = 9·10-5 mol
Calcoliamo la massa molare Mm della proteina:
Mm = gproteina / nproteina = 2,72 / (9·10-5) = 3 ·104 g/mol
la massa molecolare della proteina è quindi:
MM = 3 ·104 uma (unità di massa atomica)
Altri esercizi online e gratuiti
Li trovi al seguente link: esercizi sulle proprietà colligative.
Link correlati:
Quesito con soluzione sulla pressione osmotica
Che cos'è l'osmoregolazione?
Studia con noi