Acetilene
Produzione commerciale, caratteritiche e usi dell'acetilene
L'acetilene o etino è un idrocarburo insaturo alifatico con formula chimica C2H2.
Contiene un triplo legame carbonio-carbonio, di struttura
H-C≡C-H.
È il primo e più importante termine della serie degli idrocarburi alchini.
Ottenuto per la prima volta da E. Davy nel 1836 per reazione tra acqua e carburo di potassio, l'acetilene ha acquistato importanza pratica dopo lo sviluppo dell'industria del carburo di calcio.
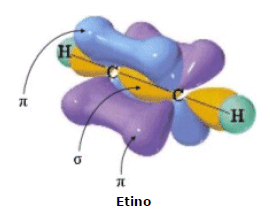
Molecola dell'acetilene
La molecola dell'acetilene è una molecola lineare; tutti e quattro gli atomi (due di carbonio e due di idrogeno) si legano lungo un unico asse molecolare che è anche un asse di simmetria.
Link correlati:
Ciascun atomo di carbonio dell'acetilene è ibridato sp e presenta quindi due orbitali 2p non ibridati resi disponibili per i legami π.
Il risultato è una molecola cilindrica nella quale gli atomi di carbonio del triplo legame sono "seppelliti" dai due sistemi di elettroni π.
Proprietà fisiche dell'acetilene
L'acetilene è un gas incolore di odore etereo; bolle a -75°C e fonde a -81,8°C.
È solubile in acqua (cosa insolita per un idrocarburo) e in alcuni solventi organici; a 30°C un litro di acqua ne scioglie circa un grammo.
La elevata solubilità sotto pressione in alcuni solventi organici è utilizzata per la sua conservazione e separazione da altri componenti gassosi che l'accompagnano nei processi di produzione.
L'acetilene forma con l'aria miscele esplosive in un intervallo larghissimo di concentrazioni (da 2,5 a 80% in volume), per cui è estremamente pericoloso.

Ad alte pressioni esplode anche solo per urto e non può pertanto essere compresso; comunemente viene trasportato e venduto in bombole, sciolto in acetone assorbito su un supporto poroso inerte.
Proprietà chimiche dell'acetilene
L'acetilene viene usato come tale per produrre temperature assai elevate (fino a 2700-2800 °C) per combustione con aria o ossigeno (fiamma ossiacetilenica).
Tuttavia l'enorme importanza industriale dell'acetilene risiede nelle sua grande reattività chimica che ne fa un intermedio assai prezioso per numerosissime sintesi.
Di seguito sono ricordate le reazioni più importanti.
Formazione di sali
A causa della particolare ibridazione (di tipo sp) che presentano gli atomi di carbonio dell'acetilene, gli atomi di idrogeno direttamente legati al carbonio con il triplo legame sono leggermente acidi se confrontati con gli idrogeni degli altri idrocarburi (pKa dell'acetilene = 25; dell'etilene = 36,5; dell'etano = 42).
L'acetilene pertanto può dare sali con molti metalli (acetiluri).
Idrogenazione.
È possibile una idrogenazione parziale dell'acetilene a etilene o totale a etano, con l'uso di catalizzatori appropriati (palladio, platino):
CH≡CH → CH2=CH2 → CH3-CH3
L'idrogenazione catalitica selettiva ha avuto una certa importanza nella produzione di etilene ed ancora viene presa in considerazione, in relazione alla necessità di allontanare completamente l'acetilene dai gas industriali che lo contengono in piccole quantità.
Addizione di acqua
In presenza di ioni mercurici come catalizzatori, l'idratazione dell'acetilene porta alla formazione di acetaldeide.
Addizione di alogeni
Con aggiunta di cloro si ottengono molti prodotti industrialmente importanti, quali solventi clorurati e intermedi per sintesi; per esempio, si ottiene tetracloroetano:
CH≡CH + 2 Cl2 → CHCl2-CHCl2
e da quest'ultimo, per eliminazione di acido cloridrico (HCl), si ottiene tricloroetilene, la notissima trielina:
CHCl2-CHCl2 → CHCl=CCl2 + HCl
Addizione di acidi
Con l'acido cloridrico, si ottiene cloruro di vinile:
CH≡CH + HCl → CH2=CHCl
La reazione viene condotta a 100-180°C in presenza di HgCl2.
Con l'acido acetico si ha acetato di vinile:
CH≡CH + CH3COOH → CH2=CH-OCOCH3
e con acido cianidrico (HCN) si ha acrilonitrile:
CH≡CH + HCN → CH2=CH-CN
Tutti questi derivati vinilici (contenenti cioè il gruppo vinile CH2=CH-) hanno grande importanza industriale come monomeri di partenza per materie plastiche (polivinilcloruro, poliacrilonitrile, polivinilacetato ecc.).
Reazioni di carbonilazione
L'acetilene può addizionare ossido di carbonio (CO) e acqua o alcoli (ROH), per dare composti acrilici:
CH≡CH + CO+ H2O → CH2=CH-COOH
CH≡CH + CO+ ROH → CH2=CH-COOR
Reazioni di etinilazione
Sono quelle reazioni di addizione dell'acetilene ad aldeidi o chetoni in cui il prodotto finale contiene ancora il gruppo etinile -C≡C-.
Per esempio:
CH≡CH + 2 CH2O → HOH2C-C≡C-CH2OH
Reazioni di polimerizzazione
Di importanza industriale è la dimerizzazione dell'acetilene a vinilacetilene (CH2=CH-C≡CH), intermedio per la sintesi del cloroprene (CH2=CH-C≡CCl=CH2) dal quale per polimerizzazione si ha il neoprene:
2 CH≡CH → CH2=CH-C≡CH
CH2=CH-C≡CH + HCl → CH2=CH-CCl=CH2
n CH2=CH-CCl=CH2 → -(CH2-CH=CCl-CH2)n-
Sintesi dell'acetilene
I procedimenti industriali di sintesi dell'acetilene oggi sono essenzialmente di due tipi, rispettivamente da carburo di calcio (CaC2) e da metano o altri idrocarburi.
I due principali metodi con cui è possibile ottenere l'acetilene sono riassunti qui di seguito:
Acetilene dal carburo
Il carburo di calcio, ottenuto da carbon coke e ossido di calcio ad alta temperatura,
CaO + 3 C → CaC2 + CO
è facilmente decomposto dall'acqua per dare acetilene secondo la seguente reazione:
CaC2 + 2 H2O →Ca(OH)2 + C2H2 + 30,9 kcal
Gli apparecchi usati nella pratica per la produzione di acetilene sono di vario tipo e la loro varietà dipende dalla quantità di gas che si vuole utilizzare. Dalle piccole lampade ad acetilene alle grosse apparecchiature industriali si è avuta una continua evoluzione verso sistemi di sicurezza atti a garantire un impiego esente da pericoli.

Vecchia lampada ad acetilene
Acetilene da idrocarburi
Ad alta temperatura (maggiore di 1000-1200°C) gli idrocarburi subiscono cracking con formazione di acetilene, che in queste condizioni è termodinamicamente più stabile.
Nel caso del metano si ha per esempio:
2 CH4 → C2H2 + 3 H2
Esistono vari processi industriali che sfruttano questa reazione e che differiscono per l'idrocarburo di partenza (metano, propano, ecc.) e per il modo di generare l'alta temperatura necessaria per il cracking, (per esempio mediante arco elettrico o, più economicamente, mediante una parziale combustione dello stesso idrocarburo con una quantità controllata di ossigeno).
Usi dell'acretilene
L'acetilene è impiegato in numerose sintesi chimiche e specialmente nel campo della fabbricazione dei monomeri per resine viniliche oltre che per la fabbricazione di aldeide acetica e di numerosi altri prodotti chimici.
Viene inoltre impiegato nel cannello per la saldatura dei metalli tramite cannelli ossiacetilenici.

Cannello ossiacetilenico
Tappe fondamentali dello sviluppo della chimica dell'acetilene
1836 - Scoperta dell'acetilene.
1860 - Preparazione allo stato puro dell'acetilene da parte di M. Berthelot il quale nota anche la formazione dell'acetilene per pirolisi dell'etilene e di altri composti (alcool, etere etilico, ecc.).
1862 - Preparazione dell'acetilene per decomposizione con acqua del carburo di calcio; nello stesso anno Berthelot sintetizza l'idrocarburo dagli elementi.
1864 - Preparazione del cloruro di vinile da acetilene e acido cloridrico.
1866 - Formazione dell'acetilene dal metano e dall'etilene per azione delle scintille elettriche. Decomposizione dell'acetilene al calor rosso in carbonio e idrogeno; trasformazione in benzene e stirene per pirolisi.
1870 - Preparazione del tetracloroetano da acetilene e cloro.
1894 - Preparazione dell'acetaldeide per idratazione dell'acetilene.
1897 - Impiego pratico dell'acetilene per ottenere il nero di acetilene.
1900 - Impiego dell'acetilene e dell'ossigeno nella saldatura.
1908 - Formazione dell'acetilene per pirolisi del metano.
1913 - Sintesi del vinilacetilene.
1929 - Sintesi del divinilacetilene.
1932 - Preparazione dell'acetonitrile da acetilene e ammoniaca.
1933 - Scoperta del neoprene. Preparazione degli eteri vinilici da acetilene e alcooli in presenza di alcali.
1937 - Preparazione dell'1,4-butindiolo.
1940 - Preparazione del ciclo-ottatetraene dall'acetilene compresso in presenza di sali di nichel.
1949 - Preparazione dell'acrilonitrile da acetilene e acido cianidrico in presenza di cloruro di rameoso.
1953 - Preparazione industriale dell'acetonitrile da acetilene e ammoniaca.
Studia con noi