Ossido di calcio
Proprietà e caratteristiche dell'ossido di calcio
L'ossido di calcio CaO è un ossido basico che si presenta come un solido di colore bianco altamente irritante e corrosivo.
È un caratteristico composto ionico in cui il calcio è il catione con carica elettrica Ca2+, mentre l'ossigeno è l'anione con carica O2−.
Come accade per tutti i composti ionici, la formula chimica non descrive una struttura molecolare, ma è una rappresentazione di comodo, che indica la proporzione esistente nel cristallo tra ioni positivi e negativi.
Nel caso dell'ossido di calcio CaO tale proporzione è di 1:1.
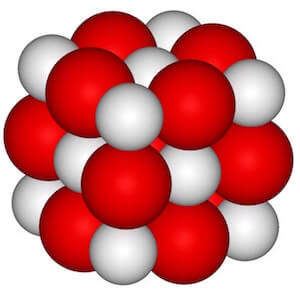
Struttura ionica del CaO.
Produzione ed usi dell'ossido di calcio
L'ossido di calcio viene prodotto tramite decomposizione termica del calcare.
Si valuta che più di un miliardo di tonnellate di calcare (roccia sedimentaria contenente 85-95% di CaCO3) vengono ogni anno, nel mondo, impiegate per la produzione dell'ossido di calcio, che, per la massima parte, è usato nell'edilizia, direttamente (calce) o indirettamente (cemento).
L'ossido di calcio viene preparato per riscaldamento a circa 800°C (in grandissimi forni verticali e rotativi) del carbonato di calcio, che si decompone secondo la reazione:
CaCO3 → CaO + CO2
Il riscaldamento del CaCO3 viene fatto con corrente di gas caldi, perché con questo sistema viene trascinato via il CO2 formatosi, e la decomposizione di CaCO3, che in ambiente chiuso a circa 800°C è una reazione di equilibrio, ha ridotte possibilità di retrocedere.
Aggiungendo H2O a CaO (calce viva) avviene la reazione (di spegnimento della calce):
CaO + H2O → Ca(OH)2 + 81,6 kJ
L'idrossido di calcio (calce spenta) è una base forte, è poco solubile e a seconda della quantità di acqua aggiunta si ottiene una massa più o meno consistente: la calce usata per le malte da costruzione (grassello) ha un rapporto molare CaO - 9H2O.
Durante l'indurimento delle malte da costruzione avvengono numerose e complesse reazioni, fra le quali ricordiamo soltanto quella dovuta al CO2 dell'aria:
Ca(OH)2 + CO2 → CaCO3 + H2O
L'acqua formatasi passa lentamente nell'atmosfera, come vapore (umidità dei muri costruiti di fresco) e la calce (pastosa) viene trasformata in calcare (duro).

Ossido di calcio. By Leiem
Altri usi dell'ossido di calcio
In laboratorio l'ossido di calcio viene utilizzato per produrre il carbonato di calcio.
Si fa reagire inizialmente l'ossido di calcio con l'acqua secondo la seguente equazione chimica vista in precedenza:
CaO + H2O → Ca(OH)2
Attraverso la soluzione di Ca(OH)2 viene fatta passare successivamente una corrente di anidride carbonica necessaria per precipitare il carbonato di calcio secondo la reazione:
Ca(OH)2 + CO2 → CaCO3 + H2O
Anche il nitrito di potassio viene preparato dall'ossido di calcio.
La preparazione industriale del nitrito di potassio avviene infatti sospendendo l'ossido di calcio in una soluzione di nitrato di potassio e facendo arrivare a caldo del biossido di zolfo privo d'aria:
KNO3 + CaO + SO2 → CaSO4 + KNO2
La resa è ottima ed il solfato di calcio poco solubile si separa facilmente.
Link correlati:
Proprietà e caratteristiche dell'ossido di berillio
Studia con noi