Acido cianidrico
Proprietà e caratteristiche dell'acido cianidrico
L'acido cianidrico è un acido debole appartenente alla famiglia degli acidi binari; ha formula chimica HCN.
Si trova nel regno vegetale combinato con glucidi e composti di natura aldeidica e chetonica.
È stato notato allo stato libero nella flora dell'isola di Giava; ciò si deve all'azione idrolizzante dei fermenti dopo l'estirpazione delle piante. L'acido cianidrico è presente anche nello spazio interstellare.
Cenni storici
Noto sotto forma di sali complessi sin dal secolo XVIII fu ottenuto nel 1782 da Scheele trattando con acido solforico il ferrocianuro di potassio e l'azzurro di Berlino.
Allo stato anidro fu ottenuto nel 1809 da Ittner e nel 1811 da Gay-Lussac, il quale nel 1815 ne stabilì la composizione.
Nel 1803 Vauquelin l'ottenne dalle mandorle amare e dai noccioli di albicocche.
Struttura dell'acido cianidrico
L'acido cianidrico può essere considerato come un sistema in equilibrio delle due forme:
![]()
Nelle condizioni ordinarie predomina la prima struttura (nitrilica), mentre la seconda struttura (isonitrilica), è presente in piccolissima quantità.
La molecola H―C≡N presenta i seguenti tipi di legame: un legame σ H—C, un legame σ e due legami π che formano il triplo legame C≡N; inoltre è presente un doppietto elettronico non impegnato sull'azoto.
L'aggruppamento CN− è isoelettronico con CO, N2NO+.
L'acido cianidrico, se non è stabilizzato, polimerizza dando un aggregato di color bruno-nero, di formula bruta (HCN)x. La reazione decorre tramite il dimero imminoacetonitrile; il polimero finale viene generalmente indicato come acido azulmico.
Struttura di Lewis dell'acido cianidrico
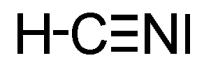
Struttura 3D

Proprietà fisiche dell'acido cianidrico
L'acido cianidrico HCN è un liquido incolore con un forte odore di mandorle amare.
È miscibile in acqua, alcool ed etere etilico in tutti i rapporti. Miscelando l'acido cianidrico in acqua si ha un forte abbassamento della temperatura; 1 mol HCN in 400 mol d'acqua assorbe 6,1 kcal.
I limiti di esplosione per HCN + aria variano dal 7% al 41% in volume (da 79 a 460 g/m3). Può essere fatto detonare con un innesco di fulminato di mercurio.
Proprietà chimiche dell'acido cianidrico
L'acido cianidrico è caratterizzato, nella sua reattività chimica, da tre possibilità di attacco, a seconda che si agisca sul legame H—C, o sul triplo legame C≡N o infine sul doppietto elettronico libero dell'azoto.
L'acido cianidrico può reagire con vari composti dei metalli e metalloidi a dare i ciano derivati corrispondenti, secondo la reazione generale:
M + X HCN → M(CN)x + X/2 H2
L'acido cianidrico può essere ridotto a metilammina:
HCN + 2 H2 → H3C―NH2
e può essere ossidato con aria a 400-600°C su catalizzatori a base di Ag o Au ad acido cianico HOCN e cianogeno (CN)2; può essere idrolizzato in ambiente acido ad acido formico e formiato d'ammonio.
In fase liquida reagisce con gli alogeni (Cl2, Br2) a dare ClCN, BrCN e (CN)2.
L'acido cianidrico reagisce con parecchi substrati organici in varie reazioni, talune d'importanza industriale. Infatti, ad esempio, in presenza di vari catalizzatori reagisce con l'acetilene dando acrilonitrile secondo la reazione:
C2H2 + HCN → CH2=CHCN
Un'altra importante reazione dell'HCN è quella di somma a composti olefinici.
L'acido cianidrico reagisce anche con aldeidi, chetoni ed eteri ciclici formando le cianidrine.
Preparazione dell'acido cianidrico
Sono diversi i metodi che possono essere utilizzati per produrre acido cianidrico. Li elenchiamo brevemente:
a) Per decomposizione dei cianuri metallici con acido solforico diluito (metodo di laboratorio):
NaCN + H2SO4 → NaHSO4 + HCN
Alternativamente ai cianuri metallici possono essere utilizzati i ferrocianuri:
2 K4Fe(CN)6 + 3 H2SO4 → 3 K2SO4 + K2Fe2(CN)6 + 6 HCN
Con acido solforico concentrato i cianuri ed i ferrocianuri danno ossido di carbonio.
b) Per combinazione diretta degli elementi sotto l'azione dell'arco elettrico. La reazione può essere resa industriale adoperando una miscela di metano (20%), azoto (70%) ed idrogeno (10%):
2 CH4 + N2 → 2 HCN + 3 H2
c) Sfruttando la seguente reazione (metodo industriale):
NH3 + CH4 + 3/2 O2 → HCN + 3 H2O
d) Per disidratazione della formammide:
CH3NO → HCN + H2O
La reazione si compie a 700-800°C usando come catalizzatori allumina, pietra pomice, zeolite, oltre che a piccole quantità di ossidi di zinco, manganese, cromo, ecc.
e) per riduzione dell'ossido di azoto. La reazione catalitica:
2 NO + 3 H2 → 2 HCN + 2 H2O
può essere resa industriale impiegando l'ossido di azoto che si ha nell'ossidazione dell'ammoniaca.
Tossicità e pericolosità dell'acido cianidrico
L'acido cianidrico è un composto estremamente tossico: 300 ppm di vapori di acido cianidrico nell'aria sono sufficienti per uccidere una persona in soli pochi minuti.
La tossicità è dovuta allo ione cianuro (CN−) che, combinandosi con il ferro dell'emoglobina, impedisce il trasporto dell'ossigeno ai tessuti e di conseguenza impedisce la respirazione cellulare.
La somministrazione per via orale di circa 1-2 milligrammi/kg di peso corporeo porta alla morte in breve tempo; una dose più alta conduce a morte pressoché istantanea.
Un potente insetticida (Zyklon B) di cui l'acido cianidrico costituisce costitutisce l'ingrediente attivo, fu utilizzato dai nazisti nelle camere a gas dei campi di sterminio.
Il trasporto per ferrovia di grandi quantità di acido cianidrico anidro è pericoloso ed è vietato, perché una lunga permanenza non è esente da pericoli di esplosione, anche se il prodotto è stabilizzato.
In piccole bombole il trasporto rapido con automezzi del prodotto stabilizzato si può fare con molta cautela. Anche l'impiego come fumigante deve avvenire a mezzo personale specializzato munito di maschere.
L'acido cianidrico anidro viene stabilizzato aggiungendo lo 0,5-1% di acido acetico glaciale o acido fosforico.
Nei casi lievi d'intossicazione con HCN gassoso sono indicati il nitrito d'amile e l'iposolfito sodico. In seguito a ingestione di cianuri è consigliato come antidoto l'ossido di magnesio con poco solfato ferroso in acqua.
Studia con noi