Idratazione
Che cos'è l'idratazione?
La solvatazione è un processo chimico che consiste nella formazione di complessi tra solvente e soluto.
Nel processo di solvatazione le molecole del soluto sono circondate e portate in soluzione dalle molecole del solvente.
Un caso particolare di solvatazione è l'idratazione: essa prevede l'utilizzo di acqua come solvente.
Quindi nel caso in cui il solvente è l'acqua la solvatazione prende il nome di idratazione.
Nel processo di idratazione le particelle del soluto (anioni e cationi) sono circondate e portate in soluzione dalle molecole dell'acqua formando ioni idrati.
Per capire il processo di idratazione consideriamo il caso dell'aggiunta del cloruro di sodio (NaCl) in acqua.
Il cloruro di sodio è un composto ionico il cui reticolo cristallino può essere rappresentato in questo modo:
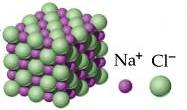
Reticolo cristallino del cloruro di sodio Na+Cl−
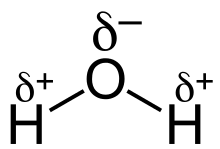
Relativamente all'acqua, possiamo dire che è un solvente polare; l'ossigeno dell'acqua, infatti, avendo una elettronegatività maggiore di quella dell'idrogeno assume una parziale carica negativa (δ−, delta meno), mentre l'idrogeno assume una parziale carica positiva (δ+, delta più). (Per approfondimenti si veda: molecola dell'acqua).
Le molecole dell'acqua, dipolari, si orientano inizialmente attorno agli ioni che costituiscono la superficie del cristallo, alcune con la parte negativa verso gli ioni positivi (Na+) e altre con la parte positiva verso gli ioni negativi (Cl−).
Esse indeboliscono così le forze di Coulomb (forze attrattive) tra cationi ed anioni e penetrano sempre più profondamente nel reticolo cristallino riuscendo a strappare gli ioni dal reticolo cristallino.
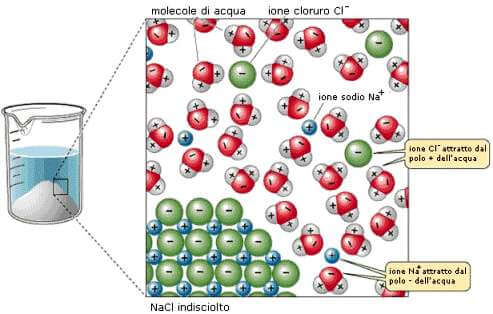
Idratazione del cloruro di sodio, NaCl
Nel processo di idratazione gli ioni vengono circondati dalle molecole di acqua. Lo ione Cl− del cloruro di sodio (NaCl) è attratto dai poli positivi dell'acqua; lo ione Na+ è invece attratto dai poli negativi dell'acqua.
Riassumendo l'idratazione
Un cristallo di cloruro di sodio è costituito da ioni Na+ e Cl− che nel passaggio in soluzione acquosa si idratano secondo la reazione:
(Na+Cl−)n + acqua → nNa+(aq) + nCl−(aq)
nella quale il subscritto (aq) sta a indicare, qualitativamente, acqua di idratazione degli ioni non stechiometricamente definita.
Anche se abitualmente gli ioni in soluzione acquosa non vengono indicati con il subscritto (aq), bisogna ricordare che essi sono sempre idratati.
Le determinazioni sperimentali del numero di molecole d'acqua di idratazione di uno ione in soluzione acquosa sono piuttosto incerte a causa dell'esistenza in soluzione di equilibri fra forme con diversi numeri di molecole d'acqua di idratazione.
L'idratazione non deve essere confusa con l'idrolisi che invece prevede una rottura della molecola dell'acqua.
L'idratazione in chimica organica
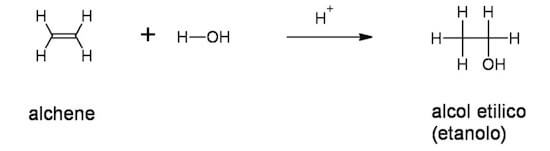
In chimica organica con il termine di idratazione (o più propriamente reazione di idratazione) si intende invece la reazione di addizione di acqua ad un generico composto organico.
Un tipico esempio è la reazione di idratazione degli alcheni (aggiunta di H2O agli alcheni) con formazione di alcoli.
Studia con noi