Proteine fibrose e globulari
Differenza tra proteine fibrose e proteine globulari
Le proteine sono le molecole organiche più abbondanti dell'organismo e svolgono molteplici funzioni.
Dal punto di vista della loro conformazione, possono essere distinte in proteine fibrose e proteine globulari. La diversa conformazione di queste due tipologie di proteine riflette anche la diversa capacità funzionale: le proteine fibrose svolgono esclusivamente funzione di sostegno e protezione, mentre le proteine globulari hanno il compito di dirigere gran parte delle funzioni fisiologiche dell'organismo.
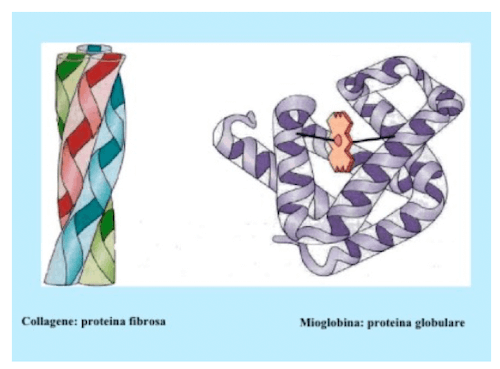
Proteine fibrose e globulari. A sx: Collagene (fibrosa) , a dx Mioglobina (globulare).
Struttura generale delle proteine
Per comprendere la differenza nelle strutture delle proteine fibrose e globulari, ha senso dare un ripasso alle caratteristiche generali della struttura delle proteine.
Queste molecole sono formate da una lunga catena di amminoacidi, legati tra loro in sequenza mediante legami peptidici.
La semplice catena lineare di amminoacidi si definisce struttura primaria. In base alla caratteristiche chimico-fisiche degli amminoacidi che la costituiscono, la catena si organizza poi in una struttura secondaria tridimensionale che è il risultato, in parte, delle forze di attrazione e repulsione ma soprattutto dell'angolazione con cui i legami chimici tra gli amminoacidi adiacenti si dispongono.
Nelle proteine umane le possibili strutture secondarie sono 3: ad alpha-elica, a foglietto ripiegato o a ripiegamenti e anse. Nella struttura ad elica, la catena lineare si avvolge intorno ad un asse; nella struttura a foglietto gli amminoacidi sono disposti in modo da formare una superficie piatta, leggermente ripiegata in maniera regolare a causa degli angoli di legame tra gli amminoacidi; nella struttura a ripiegamenti e anse la catena mostra improvvisi ripiegamenti di 180 gradi che uniscono segmenti di catena che, nella sequenza lineare, sono consecutivi mentre vengono a trovarsi adiacenti ma antiparalleli nella struttura secondaria.
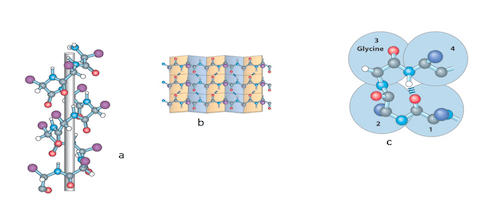
Illustrazione 2: a) struttura ad alpha-elica; b) foglietto ripiegato; c) a ripiegamenti ed anse.
Quando la struttura secondaria si avvolge ancora su se stessa, portando amminoacidi che nella sequenza primaria sono molto lontani a trovarsi vicini ed interagire tra loro, si definisce una struttura terziaria della proteina.
In alcuni casi, più sequenze di amminoacidi ripiegate in strutture terziarie si uniscono a formare un unica proteina: si dice allora che la proteina possiede una struttura quaternaria.
Proteine fibrose e globulari: differenze
Dal punto di vista strutturale, le proteine fibrose sono formate da catene assiali, lunghe e uniformi, dotate di struttura primaria e secondaria.
La struttura secondaria è la medesima lungo tutta la catena ed è di tipo ad alpha-elica o, raramente, foglietto ripiegato.
La maggior parte degli amminoacidi che forma la catena di queste proteine hanno i radicali sporgenti di tipo idrofobico, cosicché la proteina assume caratteristiche di insolubilità all'acqua. Sono resistenti e/o elastiche e hanno funzione strutturale, formando componenti anatomiche di sostegno oppure di protezione.
Le proteine globulari invece sono formate da catene ripiegate, in cui si evidenzia una struttura terziaria e talvolta anche quaternaria. Inoltre la struttura secondaria può variare lungo la catena e, in alcuni tratti, non essere affatto presente.
Possiamo così avere delle proteine globulari che hanno una parte della catena organizzata secondo lo schema ad alpha-elica ed una parte a foglietto ripiegato.
Talvolta, tra i vari tratti elicoidali si intramezzano porzioni di catena che si presentano unicamente nella loro struttura primaria lineare.
Le proteine globulari possono essere solubili in acqua, nei lipidi oppure presentare delle strutture dinamiche in grado di modificare la propria forma in risposta all'ambiente, in modo da essere solubili sia in acqua che nei lipidi.
La funzione delle proteine globulari è di tipo dinamico: ad esse appartengono ormoni, enzimi, proteine di trasporto, anticorpi e in generale tutte quelle proteine che intervengono nei processi fisiologici e metabolici dell'organismo.
Esempi di proteine fibrose
Le proteine fibrose sono quelle che definiscono gli elementi strutturali principali dell'organismo e rappresentano un terzo della componente in peso delle proteine dell'organismo. Proteine fibrose sono ad esempio quelle che compongono per la maggior parte la pelle, i capelli, le unghie, le corna.
Una delle proteine fibrose più diffuse del corpo è costituita dal collagene, che forma la parte fibrosa dei tessuti connettivi.
La struttura primaria e secondaria di questa proteina è costituita da un lungo filamento spiralizzato a formare un'elica; tre filamenti elicoidali si avvolgono insieme per formare una struttura spessa, molto resistente ma per nulla elastica.
Simile al collagene è l'elastina che, a differenza dell'altra molecola, è caratterizzata da grande elasticità ed è la componente strutturale dei tendini.
Le catene primarie dell'elastina sono simili a quelle del collagene ma non si uniscono a formare un filamento spesso: si ritrovano invece associate ad un nucleo centrale di desmosina, che fa da fulcro e conferisce elasticità alla macromolecola.
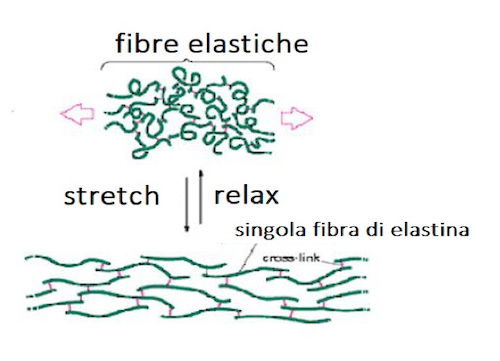
Elastina, proteina fibrosa formata da singole fibre connesse da ponti di desmosina.
Esempi di proteine globulari: la mioglobina
Tra le proteine globulari, mioglobina ed emoglobina sono tra le più caratteristiche.
La mioglobina è un monomero a struttura terziaria globulare; l'emoglobina è formata da quattro catene simili alla mioglobina unite insieme in una struttura quaternaria.
Le catene della mioglobina presentano 8 alpha-eliche inframezzate da porzioni prive di struttura secondaria, e ripiegate in modo da assumere una struttura terziaria di tipo globulare.
Associata alla catena amminoacidica c'è un gruppo chimico non peptidico, detto gruppo eme, incluso nella struttura terziaria della catena. Il gruppo eme è caratterizzato da un anello di quattro gruppi pirrolici al cui centro è situato un atomo di ferro a valenza +2.
La valenza del ferro nel gruppo eme è fondamentale per la sua funzionalità ed è mantenuta tale da una bolla idrofobica che lo avvolge impedendogli di ossidarsi.
La mioglobina è presente nei muscoli scheletrici e rappresenta una riserva di ossigeno, che si lega al ferro del gruppo eme. Se il ferro avesse valenza +3, l'ossigeno non potrebbe legarsi. L'affinità del gruppo eme con l'ossigeno varia in funzione della concentrazione di questo elemento nell'ambiente muscolare.
A riposo, la concentrazione è più elevata e le molecole di mioglobina si legano alle molecole di O2 divenendone una riserva. Quando i muscoli si attivano, la concentrazione di O2 scende e la mioglobina libera quella in essa contenuta, rendendola disponibile per il funzionamento dei muscoli.
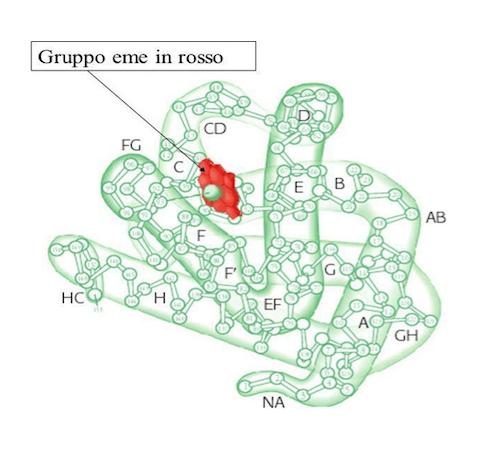
Mioglobina, tipica proteina globulare.
Link correlati:
Che cos'è l'ecogenetica?
Che cos'è l'embriologia?
Studia con noi