Peptidi
Cosa sono i peptidi e che ruolo svolgono nell'organismo?
Con il termine peptidi si indicano molecole organiche composte da una catena più o meno lunga formata da amminoacidi. Dal punto di vista strutturale le proteine sono peptidi, ma si effettua una distinzione tra queste due classi di macromolecole in quanto i peptidi sono costituiti da meno di 50 amminoacidi e hanno dimensioni inferiori ai 5000 dalton.
La struttura primaria delle proteine è costituita sempre da una catena peptidica, ma nella maggior parte dei casi le proteine sono strutture complesse in cui più catene peptidiche si uniscono insieme attraverso legami covalenti che coinvolgono le catene laterali degli amminoacidi.
Inoltre la struttura finale delle proteine può includere delle molecole diverse dai peptidi (gruppi prostetici) o talvolta ioni metallici (come nel caso dell'emoglobina).
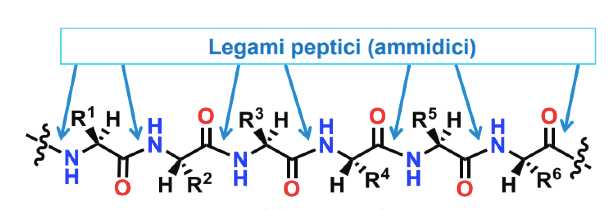
Esempio di polipeptide. Lo scheletro della molecola è costituito dalla ripetizione di -NH2-CH-CO-
Nomenclatura, classificazione e ruolo dei peptidi
In base al numero di amminoacidi che compongono la catena peptica distinguiamo: dipeptidi, tripeptidi e tetrapeptidi (formati rispettivamente da due, tre o quattro amminoacidi ). Da cinque a 50 amminoacidi si utilizza il termine generico polipeptidi.
La scrittura di un peptide parte sempre dall'aminoacido terminale che ha il gruppo amminico libero e termina con quello che ha il gruppo carbossilico libero.
Allo stesso modo, la nomenclatura di queste macromolecole si determina leggendo la sequenza amminoacidica così disposta (ad esempio, un peptide formato da glicina, alanina e serina in cui la serina ha il gruppo amminico libero si leggerà Serin-Alanin-Glicina).
Molti peptidi costituiscono gli elementi di base di cui si compongono le proteine ma alcuni hanno una propria funzione nell'organismo: tali molecole, definiti peptidi bioattivi, possono regolare e modulare i processi fisiologici a livello della risposta immunitaria, della regolazione della pressione sanguigna o della difesa da agenti patogeni.
Amminoacidi: definizione e caratteristiche
I costituenti elementari dei peptidi, ossia i "mattoncini" con cui essi sono costruiti, sono gli amminoacidi. Queste molecole organiche sono caratterizzate dalla presenza di un gruppo amminico ed un gruppo carbossilico che possono reagire tra loro formando un legame covalente molto stabile detto legame peptidico.
Gli amminoacidi in natura sono oltre 100 ma quelli che partecipano alla formazione di peptidi sono solo 20 e sono tutti del tipo α, ossia col gruppo amminico legato al carbonio α, quello adiacente al gruppo carbossilico. Il Cα lega anche la catena laterale, detta anche gruppo R, che varia da amminoacido ad amminoacido e ne determina le specifiche caratteristiche.
Gruppi R neutri daranno vita a amminoacidi neutri, gruppi R contenenti un gruppo amminico acido o un gruppo carbossilico basico daranno vita ad amminoacidi acidi o basici, il cui punto isoelettrico (ossia il pH a cui l'amminoacido è neutro) è, rispettivamente, minore di 4 o superiore a 7.
In corrispondenza del punto isoelettrico, l'amminoacido si trova in una condizione detta zwitterione, in cui può comportarsi da acido o da base in base alla eventuale variazione del pH esterno. A pH maggiore o minore del Punto isoelettrico gli amminoacidi si protonano o deprotonano, assumendo o perdendo un protone.
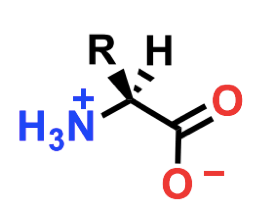
Zwitterione. Variazioni di pH possono protonare o deprotonare questa forma, trasformandolo in un anione o un catione.
Le caratteristiche di acidità degli amminoacidi che compongono una catena peptidica ne determinano il relativo comportamento in funzione del pH ambientale, condizionandone soprattutto la solubilità.
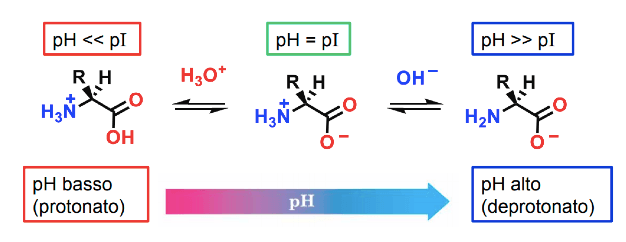
Effetti del pH sugli amminoacidi.
Legame disolfuro
Oltre al legame amminico, gli amminoacidi all'interno dei peptidi possono legarsi covalentemente attraverso legami disolfuro.
Questo tipo di legami coinvolge i gruppi tiolo (-SH) presenti nei residui di cisteina, che possono interagire tra loro formando legami covalenti detti, appunto, legami (o ponti) disolfuro.
Questa tipologia di legame è spesso la causa del legame laterale tra diverse catene peptidiche nella formazione di proteine complesse, formate da più sub-unità costituite per l'appunto dai vari peptidi.
In altri casi, i legami disolfuro possono unire tra loro amminoacidi presenti sullo stesso peptide, andando a creare degli anelli lungo la catena lineare.
Sintesi dei peptidi
All'interno delle cellule i peptidi vengono sintetizzati attraverso i processi di sintesi proteica che coinvolgono RNA, ribosomi e enzimi.
In laboratorio è possibile sintetizzare peptidi a partire dai residui amminoacidici necessari seguendo dei passaggi specifici. La sintesi di peptidi in laboratorio è molto utile sia in campo farmacologico, per la realizzazione di molecole bioattive di uso medico e anche in ambito chimico per l'analisi dei rapporti tra struttura e funzione delle proteine o per investigare il ruolo di singoli amminoacidi nella capacità della catena di assolvere ai propri compiti biochimici.
La sintesi dei dipeptidi viene eseguita riscaldano adeguatamente una miscela dei due peptidi costituenti, attuando però una accortezza per evitare che si formino accoppiamenti errati. Se non si prendesse alcuna precauzione, infatti, si otterrebbe una miscela di dipeptidi, tripeptidi e polipeptidi in cui i due amminoacidi sono legati in ordine del tutto casuale.
Per evitarlo, si utilizzano dei protettori che legano il gruppo carbossilico dell'amminoacido terminale e quello amminico dell'amminoacido iniziale della catena, in modo che si possano formare solo dipeptidi costituiti dai due amminoacidi alternati nell'ordine corretto.
Per produrre sequenze di maggiori dimensioni, si può procedere per allungamento graduale, in cui si aggiungono uno per volta amminoacidi nuovi alle sequenze prodotte, oppure per condensazione di segmenti, in cui vengono prodotti e successivamente uniti segmenti peptidici di lunghezza progressiva.
I composti protettori devono legare (inattivandoli) i gruppi amminici e carbossilici mirati ed anche i possibili gruppi reattivi sulle catene laterali.
I legami tra i protettori e i gruppi sugli amminoacidi intermedi della catena devono essere di tipo labile, per poter essere rotti facilmente nella successive fasi di elaborazione dei composti. Quelli che coinvolgono gli amminoacidi terminali e i gruppi laterali devono essere di stabilità maggiore.
I legami più stabili, ovviamente, saranno quelli peptidici che si instaureranno tra gli amminoacidi lungo la catena.
Link correlati:
In botanica che cosa è l'appassimento?
Che cos'è il nucleocapside?
Studia con noi