Massa atomica e massa molecolare
Come si calcola la massa atomica e massa molecolare
Le masse degli atomi misurate in chilogrammi o in grammi sono valori molto piccoli.
Ad esempio, la massa di un atomo di carbonio-12 corrisponde a 1,99·10-26 kg.
Non è conveniente, da un punto di vista pratico usare numeri così piccoli.
È più conveniente infatti usare masse atomiche relative, cioè masse atomiche che sono rapportate ad una grandezza di riferimento.
Massa atomica relativa
I chimici, hanno introdotto una opportuna massa di riferimento che è l'unità di massa atomica (chiamata anche Dalton) che corrisponde alla dodicesima parte della massa di un atomo di carbonio-12 ovvero a 1,66·10-27 kg.
La massa atomica relativa di un atomo è determinata per confronto con l'unità di massa atomica; essendo una massa relativa dovrebbe essere una grandezza adimensionale (non dovrebbe avere unità di misura), ma nella comune pratica viene espressa in u cioè in uma (unità di massa atomica).
Le masse atomiche sono di solito elencate nella tavola periodica.
La massa atomica di un atomo di ossigeno è 16 volte l'unità di massa atomica, cioè 16u, mentre la massa di un atomo di fluoro è circa 19 volte l'unità di massa atomica, cioè 19u.
Pertanto: la massa atomica relativa indica quante volte la massa di un atomo è maggiore rispetto a un dodicesimo della massa del carbonio-12.
Da questa quest'ultima definizione è chiaro che la massa atomica relativa è una grandezza adimensionale (infatti esprime solo "quante volte la massa di un atomo è maggiore rispetto a un dodicesimo della massa del carbonio-12"), ma normalmente, ed erroneamente, viene espressa in u, cioè uma.
Quindi, il valore della massa atomica relativa (detta anche peso atomico) è una grandezza espressa da un numero puro ovvero adimensionale trattandosi di una grandezza relativa.
Stesso discorso vale per la massa molecolare relativa detta anche peso molecolare.
Massa molecolare relativa
La massa di una molecola, detta massa molecolare, è uguale alla somma delle masse atomiche di tutti gli atomi che compongono la molecola.
Vediamo come eseguire il calcolo della massa molecolare di CH3CH2Cl
2 atomi di C = 2 · 12,01 = 24,02 u
5 atomi di H = 5 · 1,01 = 5,05 u
1 atomi di Cl = 1 · 35,45 = 35,45 u
---------------
massa molecolare = 64,52 u
I chimici usano spesso i termini peso atomico (PA) di un elemento al posto di massa atomica (MA) e peso molecolare (PM) di un composto al posto di massa molecolare (MM). Queste dizioni risultano improprie, perché le quantità in esame sono masse e non pesi.
Peso formula
Nei composti ionici la formula chimica non descrive una struttura molecolare ma indica in quale proporzione sono presenti nel cristallo gli ioni positivi e negativi.
Ad esempio, nel caso del cloruro di sodio NaCl tale proporzione è di 1:1, mentre nel caso del fluoruro di calcio CaF2 tale proporzione è di 1:2.
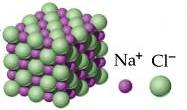
Cristallo di NaCl
Nel caso di composti ionici che, come detto, non sono formati da molecole, è quindi improprio parlare di massa molecolare. In questi casi è preferibile utilizzare il termine peso formula. Anche il peso formula si esprime in uma.
Esercizio
La massa atomica del rame è 63,55 uma.
Determina la massa in grammi del rame.
La soluzione dell'esercizio la trovi qui: da uma a grammi.
Link correlati:
Tool gratuito e online per il calcolo della massa molecolare
Esercizi sul calcolo della massa molecolare
Esercizi svolti e commentati sulla formula minima e molecolare
Tool per il calcolo online del numero di moli
Differenza tra massa atomica e peso atomico
Quanto vale il peso atomico dell'ossigeno?
Studia con noi