Verifica sperimentale della legge di Lavoisier
Relazione di laboratorio: verifica sperimentale della legge di Lavoisier
Introduzione
Una delle leggi fondamentali della chimica è la legge della conservazione della massa; nota anche come legge di Lavoisier, afferma che: durante una reazione chimica la massa si mantiene costante.
Scopo dell'esperienza
Verificare la legge della conservazione della massa (legge di Lavoisier), ovvero che, in una reazione chimica, la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.
Osservare qualitativamente alcuni fenomeni che si manifestano durante le reazioni chimiche.
Attrezzature
Bilancia tecnica di sensibilità 0,01 g
Palloncino di gomma
Beute da 250 mL munite di tappi in gomma
Nastro adesivo
Materiali e reagenti
Ghiaccio in cubetti
Zucchero in zollette
Bicarbonato di sodio NaHCO3
Ioduro di potassio KI
Nitrato di piombo Pb(NO3)2
Conservazione della massa durante il processo di fusione
Procedimento
Inserire all'interno di una beuta da 250 mL alcuni cubetti di ghiaccio e chiudere la beuta con un tappo in gomma.
Pesare la beuta tappata contenete i cubetti di ghiaccio (m1).
Fare sciogliere il ghiaccio.
Asciugare con della carta assorbente l'esterno della beuta sulla quale si è condensata l'umidità atmosferica. Pesare nuovamente la bauta (m2).
Confrontare le due pesate.
Conservazione della massa durante il processo di solubilizzazione
Introdurre in una beuta da 250 mL circa 125 mL di acqua.
Porre sull'imboccatura della beuta un vetrino da orologio contenente due zollette di zucchero e pesare il tutto (m3).
Introdurre le zollette di zucchero nell'acqua; fare roteare la beuta in modo da sciogliere completamente lo zucchero nell'acqua.
Pesare la beuta contenente l'acqua zuccherata insieme al vetrino da orologio (m4).
Confrontare le due pesate (m3 ed m4).
Conservazione della massa nelle reazioni chimiche in cui si ha sviluppo di gas
Parte a
Introdurre in una beuta da 250 mL circa 100 mL di aceto.
Porre sull'imboccatura della beuta un vetrino da orologio contenente un cucchiaio piccolo di bicarbonato di sodio (m5).
Introdurre il bicarbonato di sodio all'interno della beuta contenente l'aceto e fare roteare la beuta in modo da fare reagire completamente il bicarbonato.
Pesare la beuta insieme al vetrino da orologio (m6).
Confrontare le due pesate (m5 ed m6).
Parte b
Introdurre in una beuta da 250 mL un cucchiaio piccolo di bicarbonato.
Inserire all'interno della beuta, in modo tale che rimanga in piedi, una provetta riempita per ¾ con aceto.
Chiudere la beuta con un palloncino di gomma. Serrare con nastro adesivo il palloncino alla beuta.
Pesare tutto il sistema (m7).
Inclinare la beuta in modo da fare fuoriuscire dalla provetta parte dell'aceto. Il gas sviluppato dalla reazione riempie il palloncino e non si disperde.
Quando l'effervescenza è cessata pesare nuovamene la beuta (m8).
Confrontare le due pesate (m7 ed m8).
Conservazione della massa nelle reazioni chimiche in cui si ha la formazione di un precipitato
In una becher da 200 mL inserire circa 50 mL di acqua e aggiungere una spatola di ioduro di potassio. Sciogliere con una bacchetta il soluto.
In un'altra becher da 250 mL inserire circa 50 mL di acqua e aggiungere una spatola di nitrato di piombo. Sciogliere con una bacchetta il soluto.
Pesare insieme i due becher contenenti le due soluzioni (m9).
Versare il contenuto di un becher all'interno dell'altro becher. Si sviluppa una reazione con formazione di un solido giallo.
Pesare i due becher (m10).
Confrontare le due pesate (m9 ed m10).
Elaborazione ed analisi dei dati
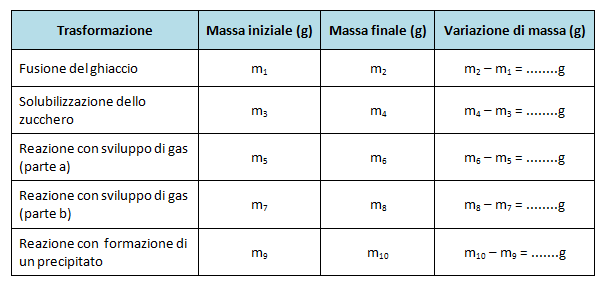
Compilare la seguente tabella:
Conclusioni
In base alle osservazioni qualitative fatte sui fenomeni che si sono svolti durante le trasformazioni, possiamo concludere che le prime due trasformazioni (fusione del ghiaccio e solubilizzazione dello zucchero) sono trasformazioni fisiche, mentre le restanti sono trasformazioni chimiche.
Nel caso della reazione con sviluppo di gas (parte a) la trasformazione avviene con dispersione della CO2 prodotta e quindi si registra una diminuzione della massa che corisponde alla quantità di gas sviluppata dalla reazione. In questo caso non è possibile dimostrare la validità della legge di Lavoisier.
Nella parte b della stessa reazione, la trasformazione chimica avviene senza dispersione di CO2 e la massa complessiva rimane costante. In questo caso e anche nei restanti, è stato possibile dimostrare la validità della legge di Lavoisier.
Link correlati:
Esperimento di laboratorio: l'uovo di gomma
Studia con noi