Quesito sulla pressione osmotica
Quesito con soluzione sulla pressione osmotica
Volumi uguali di soluzioni acquose di glucosio (C6H12O6) e di cloruro di sodio (NaCl) aventi la stessa molarità, sono posti nei due rami di un tubo ad U separati da una membrana semipermeabile. La situazione iniziale è pertanto rappresentata dalla seguente figura:
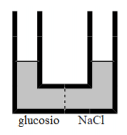
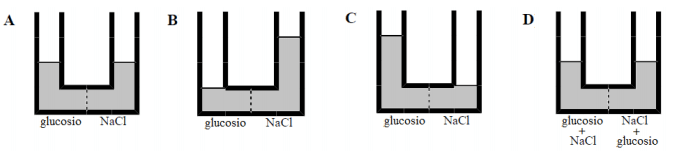
Si individui quale tra le seguenti (A, B, C, D) è la figura che meglio rappresenta la situazione finale di equilibrio.
Svolgimento dell'esercizio
Nei due rami di un tubo a U separati da una membrana semipermeabile vengono posti due volumi uguali di due soluzioni (rispettivamente di glucosio e di NaCl) di uguale molarità. Si chiede di individuare quale tra le figure descrive meglio la situazione finale.
Verrebbe da pensare che la figura A sia quella che meglio rappresenta la situazione finale, ma non è così. Infatti pur avendo la stessa molarità, le due soluzioni mostrano una pressione osmotica diversa.
La pressione osmotica è infatti data dalla seguente formula:
![]()
in cui i è il coefficiente di Van't Hoff, un coefficiente adimensionale che tiene conto del tipo di soluto.
Considerato che il glucosio è un non elettrolita, si ha che i = 1; per NaCl (NaCl → Na+ + Cl−) si ha che i = 2. Pertanto la pressione osmotica della soluzione di NaCl è doppia rispetto a quella del glucosio e quindi la figura A non può rappresentare la situazione finale.
Neanche la figura D può rappresentare la situazione finale, infatti la membrana semipermeabile, per sua stessa natura, lascia passare solo le molecole di acqua e quindi non permette il mescolamento dei due soluti.
Rimangono possibili le situazioni rappresentate dalla figura B e dalla figura C.
Essendo la pressione osmotica della soluzione di NaCl maggiore della pressione osmotica della soluzione di glucosio, il solvente si sposta spontaneamente dal ramo di sinistra a quello di destra (ovvero dalla soluzione a pressione osmotica minore alla soluzione a pressione osmotica maggiore). Quindi la figura che meglio rappresenta la situazione finale è la figura B.
Studia con noi