Elettrochimica
L'elettrochimica: celle galvaniche ed elettrolisi
L'elettrochimica è quella branca della chimica che studia i fenomeni relativi alla trasformazione dell'energia chimica di legame in energia elettrica e viceversa.
Una reazione redox è una reazione nella quale gli elettroni passano spontaneamente da una sostanza che si ossida ad una sostanza che si riduce.
Facendo avvenire una reazione redox non direttamente ma costringendo gli elettroni scambiati a passare attravaerso un filo elettrico esterno, è possibile sfruttare queste tipi di reazioni per produrre corrente elettrica.
Tale processo è possibile e viene fatto avvenire in dispositivi noti come celle galvaniche o pile.

Le pile a bottone sono un esempio di celle galvaniche.
Al contrario, fornendo energia elettrica al sistema, è possibile fare avvenire una reazione redox in senso inverso a quello spontaneo.
In tale caso l'energia elettrica viene convertita in energia chimica di legame. Tale processo viene fatto avvenire in dispositivi noti come celle elettrochimiche. Il processo viene chiamato elettrolisi.
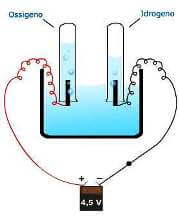
Consumando energia elettrica, in una cella elettrolitica è possibile produrre idrogeno e ossigeno dall'acqua.
Differenza tra celle galvaniche e celle elettrolitiche
Concludendo:
le celle galvaniche producono energia elettrica sfruttando reazioni spontanee di ossido-riduzione. In esse l'energia chimica di legame viene convertita in energia elettrica.
le celle elettrolitiche consumano energia elettrica per far avvenire reazioni di ossido-riduzione non spontanee. In esse l'energia elettrica viene convertita in energia chimica di legame.
Esercizi sull'elettrolisi
Li trovi al seguente link: esercizi sull'elettrolisi.
Link correlati:
Che cos'è l'elettrodialisi?
Che cos'è e per cosa viene impiegata l'elettrosmosi?
Qual è la differenza tra anodo e catodo?
Studia con noi