Tensione di Vapore
Definizione e spiegazione della tensione di vapore
L'evaporazione è il passaggio allo stato di vapore delle particelle che costituiscono un liquido.
I liquidi evaporano in misura maggiore o minore a seconda delle entità delle forze che mantengono unite nel liquido le particelle che lo costituiscono (forze intermolecolari).
Consideriamo il fenomeno con un certo dettaglio: un liquido è costituito da particelle in moto che, per un dato valore della temperatura, hanno una determinata energia cinetica media.
Sappiamo che questi valori medi esistono in conseguenza della distribuzione statistica dell'energia cinetica delle particelle di Maxwell-Boltzmann e pertanto nel liquido esistono particelle con energia cinetica maggiore e particelle con energia cinetica minore dell'energia cinetica media.
Perché una particella si allontani dalla massa di liquido di cui fa parte, cioè evapori, è necessario che essa abbia energia sufficiente per sottrarsi all'azione attrattiva delle altre particelle.
Ovviamente sono le particelle a più elevato contenuto di energia cinetica quelle che hanno la possibilità di passare allo stato di vapore.
Immaginiamo ora di riempire parzialmente con un liquido un recipiente chiuso nel quale sia stato fatto precedentemente il vuoto e che sia mantenuto a temperatura costante.
Succede che un certo numero di particelle evaporano e stabiliscono una pressione gassosa al di sopra del liquido, che aumenta proporzionalmente al numero di particelle evaporate.
Queste particelle hanno una certa probabilità di incontrare la superficie del liquido e di tornare a far parte di esso (condensazione del vapore).
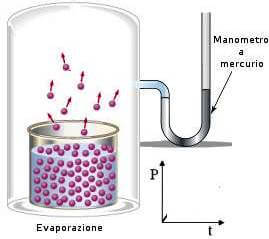
Inizialmente, il numero di particelle che evaporano è maggiore del numero di particelle che condensano.
Dopo un certo periodo di tempo, si stabilisce però un equilibrio dinamico: il numero delle particelle che abbandona la superficie del liquido diventa uguale al numero delle particelle che nello stesso tempo vi ritornano; tale scambio è perenne.
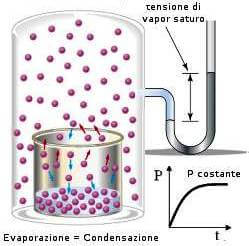
La pressione gassosa corrispondente all'equilibrio liquido-vapore alla temperatura t, viene indicata come pressione di vapor saturo o più comunemente come tensione di vapore (o pressione di vapore) del liquido considerato; il suo valore è costante a temperatura costante.
Secondo la legge di Raoult, una soluzione contenente un soluto non volatile presenta una minor tensione di vapore rispetto a quella del solvente puro.
Studia con noi