Acido ipocloroso
Proprietà e caratteristiche dell'acido ipocloroso
L'acido ipocloroso è un acido ternario con formula chimica HClO.
Esiste solo in soluzione acquosa e si decompone lentamente svolgendo ossigeno al quale si devono le sue spiccate proprietà ossidanti:
2 HClO → 2 H+ + 2Cl− + O2
è un acido debole, (Ka = 3,0 · 10-8 a 25°C) , dieci volte più debole dell'acido carbonico. Si ionizza nel seguente modo:
HClO + H2O ⇄ H3O+ + ClO−
Le soluzioni assai diluite sono incolori, quelle più concentrate giallo-verdognole; presenta un odore caratteristico simile a quello del cloruro di calcio.
L'acido ipocloroso si trova in equilibrio con la sua anidride (anidride ipoclorosa):
Cl2O + H2O ⇄ 2 HClO
Si decompone facilmente specialmente alla luce, con svolgimento di ossigeno e contemporanea formazione di acido clorico.
Dapprima l'acido ipocloroso si decompone parzialmente con svolgimento di ossigeno nascente:
HClO → HCl + O
il quale poi ossida l'acido ipocloroso rimasto inalterato:
HClO + 2O → HClO3
L'acido ipocloroso è un forte ossidante e sbiancante: ossida il ferro a FeCl3, il Pb(OH)2 a PbO2, l'acido cloridrico HClO3 a cloro Cl2, lo ioduro potassico KI a iodio I2 e decolora molti coloranti organici.
Struttura dell'acido ipocloroso
La formula chimica dell'acido ipocloroso andrebbe scritta HOCl e non HClO onde mettere in evidenza che il protone H+ è legato all'ossigeno e non al cloro come risulta dalla seguente struttura:
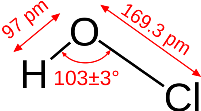
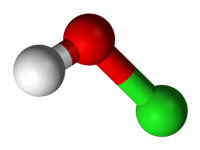
Struttura 3D
Preparazione dell'acido ipocloroso
L'acido ipocloroso lo si ottiene facendo gorgogliare CO2 in una sospensione di cloruro di calce Ca(ClO)2.
Gli ioni ipoclorito liberati dal cloruro di calce idrolizzano in soluzione acquosa secondo la reazione:
ClO− + H2O ⇄ HClO + OH−
L'idrolisi viene favorita dalla CO2 che viene fatta gorgogliare in quanto reagisce con gli ioni OH− (CO2 + OH− ⇄ HCO3−) e sposta l'equilibrio precedente verso destra.
L'acido ipocloroso lo si può ottenere anche facendo gorgogliare cloro in acqua.
H2O + Cl2 → HCl + HClO
Si ottiene puro anche da ossido di mercurio o carbonato di argento, secondo le reazioni:
2 HgO + 2 Cl2 + H2O → Hg2OCl2 + 2 HClO
Ag2CO3 + 2 Cl2 + H2O → 2 AgCl + CO2 + 2 HClO
in cui i prodotti secondari sono gassosi o insolubili.
Usi dell'acido ipocloroso
Piccole quantità di acido ipocloroso vengono usate per la preparazione di ipocloriti inorganici solidi partendo dai corrispondenti ossidi.
L'acido ipocloroso ha acquistato invece grande importanza industriale per la preparazione di cloridrina e di glicoli dalle olefine.
Per la preparazione della cloridrina etilenica si introduce, per esempio, una miscela di etilene e di biossido di carbonio in soluzione di ipoclorito sodico:
NaClO + H2O + CO2 → NaHCO3 + HClO
HClO + H2C=CH2 → CH2Cl―CH2OH
Si può anche usare acqua di cloro che reagisce come una soluzione di acido ipocloroso e di acido cloridrico od introdurre cloro in soluzione di ipoclorito e far reagire l'acido ipocloroso così ottenuto con le olefine.
Studia con noi