Colloidi
Generalità e proprietà dei colloidi
Oltre alle soluzioni vere, per le quali sono valide le proprietà colligative, esistono particolari miscugli detti colloidi.
I colloidi sono miscugli costituiti da particelle solide o liquide, con diametro compreso tra 5 e 200 nm, disperse in un fluido (liquido o gas).
I sistemi colloidali possono essere di varia natura, come ad esempio fumi (solido disperso in un gas), sistemi colloidali propriamente detti (solido disperso in liquido), emulsioni (liquido in liquido), nebbie (liquido in gas) etc.
Se la fase disperdente, liquida o gassosa, è in quantità maggiore della fase dispersa solida di dimensioni ultramicroscopiche, si ha un sol (termine derivato da soluzione).
A seconda della natura della fase disperdente esso viene chiamato con nomi diversi: idrosol, alcosol, aerosol, ecc..
Se invece è maggiore la quantità della fase solida, rispetto alla fase liquida o gassosa, si ha un gel (termine derivato da gelatina).
I colloidi presentano specifiche caratteristiche e proprietà, una fra questi è l'effetto Tyndall.
Criteri di distinzione tra soluzioni, colloidi e sospensioni
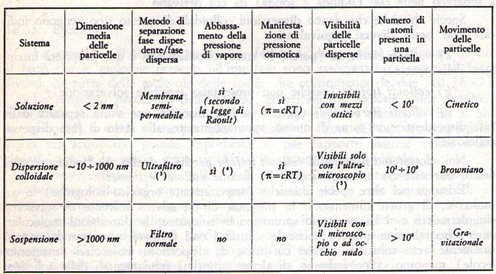
Il parametro più importante nel campo dei sistemi colloidali è la dimensione media delle particelle disperse o, meglio, il numero approssimativo medio degli atomi presenti in ciascuna particella; questo valore infatti consente di decidere se si ha a che fare con una soluzione (che gode di tutte le proprietà delle soluzioni come ad esempio le proprietà colligative), o con una dispersione colloidale (che manifesta solo alcune delle proprietà delle soluzioni come ad esempio apprezzabile pressione osmotica ma non rilevabile abbassamento della tensione di vapore), o con una sospensione (costituita da particelle sospese in un liquido che tendono a sedimentare rapidamente), che non presenta più alcuna proprietà delle soluzioni.
Soluzioni, colloidi , sospensioni, non sono però separate nettamente, perché le proprietà di questi sistemi variano in modo quasi continuo passando dall'uno all'altro.
Nella seguente tabella vengono indicati i criteri di distinzione tra soluzioni, dispersioni colloidali e sospensioni.
I sistemi colloidali rivestono una notevole importanza nei processi biologici e trovano impiego nell'industria.
Esempi di processi biologici in cui sono coinvolti i colloidi sono le cellule e le loro membrane cellulari, il plasma sanguigno e la maggior parte dei liquidi circolanti nelle piante e negli animali.
Esempi di applicazioni industriali si riscontrano invece nel settore dei farmaci, dei materiali plastici e ceramici e nella concia delle pelli.
Moto browniano
Le particelle colloidali sono soggette al moto browniano.
Colloidi: "soluzioni false"
I colloidi sono anche detti "soluzioni false", in quanti i suoi costituenti, la fase disperdente e la fase dispersa, sono sempre riconoscibili con uno o più mezzi.
In una "soluzione vera", invece, la fase disperdente (detta, in questo caso, solvente) e la fase dispersa (detta, in questo caso, soluto) sono intimamente miscelate e indistinguibili anche al microscopio ottico.
Link correlati:
Che cos'è la gelatina animale?
Studia con noi