Ossido ferrico
Proprietà e caratteristiche dell'ossido ferrico
L'ossido ferrico o ossido di ferro (III) o triossido di diferro è un ossido metallico con formula chimica Fe2O3.
Si presenta come un solido di colore rosso-bruno, inodore, insolubile in acqua, con densità pari a 5,25 g/cm3 (t = 25°C).
Insieme all'ossido ferroso (FeO) e all'ossido ferroso-ferrico (Fe3O4), l'ossido ferrico è uno dei tre principali ossidi del ferro; lo si trova in natura nel minerale magnetite.
È uno dei costituenti della ruggine, un materiale che si forma dall'ossidazione del ferro e che, da un punto di vista chimico, è considerato un ossido di ferro idrato.
Fe2O3 esiste in vari tipi di polimorfi: il più comune è la forma α-Fe2O3, con struttura romboedrica; la forma alfa si presenta in natura nell'ematite un minerale da cui viene estratto il ferro metallico.
Formula dell'ossido ferrico
Il ferro è un elemento chimico appartenente al gruppo dei metalli di transizione; può avere due numeri di ossidazione: +2 e +3: il suffisso -ico si riferisce al ferro con numero di ossidazione più alto, ovvero +3.
Gli ossidi basici sono composti binari costituiti da ossigeno (con numero di ossidazione -2) e da un metallo (ferro) che nel nostro caso ha, come detto in precedenza, numero di ossidazione +3.
L'ossido ferrico è pertanto un ossido con formula chimica Fe2O3: Fe (con numero di ossidazione +3) e O (con numero di ossidazione -2) devono essere infatti nel rapporto 2 : 3 per bilanciare le rispettive cariche formali.
Forme idrate
L'ossido ferrico esiste in varie forme idrate: tra queste ricordiamo il diidrato Fe2O3·H2O (scritto anche come Fe(O)OH) e il γ-Fe2O3 che costituisce il minerale lepidocrocite noto anche come esmeraldite o idroematite.
Sintesi
L'ossido ferrico può essere ottenuto in laboratorio per elettrolisi di una soluzione di bicarbonato di sodio utilizzando un anodo di ferro:
4 Fe + 3 O2 + 2 H2O → 2 Fe2O3·H2O
Per disidratazione del diidrato, alla temperatura di 200 °C, è possibile ottenere l'ossido ferrico anidro:
Fe2O3·H2O → Fe2O3 + H2O
Reazioni
La reazione più importante, che viene sfruttata industrialmente per la produzione del ferro metallico, è quella relativa alla sua riduzione carbotermica:
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Un'altra importante reazione dell'Fe2O3 è quella che viene sfruttata in alluminotermia per la preparazione di ferro fuso. In questi tipi di reazione si sfrutta l'elevata affinità dell'alluminio per l'ossigeno; Al si comporta infatti da energico riducente per molti ossidi metallici (e quindi anche per Fe2O3), secondo la reazione fortemente esotermica:
2 Al + Fe2O3 → Al2O3 + 2 Fe + calore
Tale reazione viene impiegata nella saldatura di parti massicce di ferro quali, ad esempio, le rotaie.
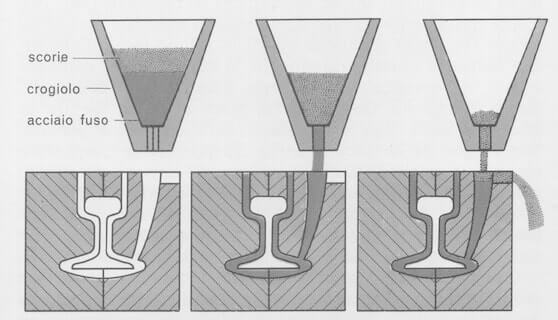
Esempio di saldatura alluminotermica di una rotaia. Nel crogiolo viene introdotta la miscela di ossido di ferro e di alluminio in polvere; questa, dopo innesco, dà luogo alla formazione di ferro fuso che cola tra le parti da congiungere.
Un'altra importante reazione di Fe2O3 è quella che dà con altri ossidi metallici (come ad esempio l'ossido di zinco, ZnO) grazie alla quale si ottengono materiali noti come ferrati:
ZnO + Fe2O3 → Zn(FeO2)2
Impieghi
Fe2O3 trova impiego:
- nella produzione del ferro;
- come pigmento per vernici con nomi quali "rosso indiano", "rosso persiano" e "ossido del Golfo Persico";
- nei cosmetici;
- nei composti di lucidatura;
- in medicina nella composizione di svariati farmaci utilizzati per trattare il prurito lieve.
In passato l'ossido ferrico è stato impiegato nei supporti di memorizzazione e registrazione magnetici, come ad esempio dischi magnetici e nastri magnetici.
Link correlati:
Proprietà e caratteristiche dell'ossido di calcio
Caratteristiche e proprietà dell'ossido di magnesio
Studia con noi