Acido salicilico
Proprietà e caratteristiche dell'acido salicilico
L'acido salicilico, (o acido o-idrossibenzoico) è un acido organico con la seguente struttura:
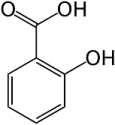
Si trova libero in natura in numerosi fiori (tulipano, giacinto, violetta, ecc.) e frutti (fragole, uva e quindi nel mosto) e come glucoside (salicina) dell'estere metilico in Spiraea ulmaria ed in altri tipi di spirea, nei fiori di alcune acacie e nelle foglie di varie gaulterie e della betulla.
L'acido salicilico, contenendo il carbossile acido e l'ossidrile fenolico, presenta le reazioni degli acidi e dei fenoli e si colora in violetto con cloruro ferrico.
Fonde a 159°C, ma sublima già a 76°C; è poco solubile in acqua fredda, più nella calda, facilmente negli alcooli, ma poco in CCl4 e C6H6. Facilmente solubile anche in etere, acetone e in ammoniaca liquida.
Già sui 200°C inizia a decomporsi in fenolo ed anidride carbonica.
La costante di dissociazione acida ed il pK a 25°C sono:
Ka = 1,06 · 10-3; pK = 3
quindi, l'acidità dell'acido salicilico è notevolmente maggiore di quella dell'acido benzoico (pK = 4,17).
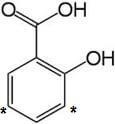
L'andamento delle sostituzioni elettrofile aromatiche nel nucleo è dominato dall'OH fenolico, quindi la nitrazione, la solfonazione e l'alogenazione procedono in orto ed in para all'OH (posizione 3 e 5: numerazione dal COOH - posizioni contrassegnate con * - ).
Preparazione dell'acido salicilico
L'acido salicilico fu ottenuto la prima volta da Piria per azione dell'idrossido di potassio sull'aldeide salicilica, come risultato della reazione di Cannizzaro.
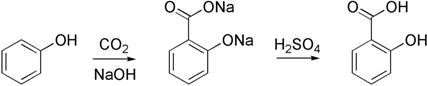
Sino al 1874 l'acido salicilico è stato ottenuto per saponificazione dell'estere metilico naturale (gaulteria e betulla), ma già dal 1859 ne era nota la sintesi da fenolo e CO2 (Kolbe), modificata poi da Schmitt verso il 1885.
Secondo tale metodo di sintesi, l'acido salicilico viene preparato trattando il fenossido sodico (sale sodico del fenolo) con CO2 ad alta pressione (100 atm) e ad alta temperatura (390 K). L'acidificazione del prodotto con acido solforico dà l'acido salicilico:
Usi dell'acido salicilico
L'acido salicilico è il prodotto di partenza per importanti derivati di applicazione farmaceutica (sali, aspirina, salolo, ecc.).
è tossico e possiede notevoli proprietà antisettiche e batteriostatiche (2,2 volte più del fenolo): si usa quindi come disinfettante ed antifermentativo (l'impiego nei prodotti alimentari, in Italia, è generalmente proibito).
è largamente impiegato nella manifattura di coloranti a mordente, di azoici e di coloranti del trifenilmetano, ecc.; viene pure impiegato per alcune resine e come ritardante nella vulcanizzazione del caucciù.
L'acido salicilico è noto per la sua capacità di alleviare i dolori e ridurre la febbre; queste sue proprietà medicinali erano conosciute fin dai tempi antichi.
L'acido salicilico è anche un ingrediente chiave in molti prodotti per la pelle per il trattamento della dermatite seborroica, acne, psoriasi, calli, duroni, ittiosi, e verruche. Viene usato anche in molti shampoo per il trattamento della forfora.
Studia con noi