Gas reali
Che cosa sono i gas reali?
Si definisce gas reale un gas il cui comportamento si discosta da quello tipico dei gas ideali; tale scostamento è tanto più evidente quanto più bassa è la temperatura del gas e quanto più alta è la sua pressione.
Il comportamento dei gas ideali (o gas perfetti) è efficacemente illustrato dalle leggi generali dei gas (legge di Boyle, legge di Gay-Lussac, legge di Charles, equazione di stato dei gas perfetti), non sempre i gas mostrano un comportamento che rispettano tali le leggi; tali tipi di gas sono detti gas reali.
Fattore di comprimibilità
Un modo per stabilire di quanto il comportamento di un gas reale si discosta dall'idealità è definire il suo fattore di comprimibilità.
L'equazione di stato dei gas perfetti è la seguente:
P · V = n · R · T
che può essere riscritta nella forma seguente:
![]()
Siccome molti gas (gas reali) mostrano un comportamento che si discosta dalla idealità, è possibile definire un fattore, noto come fattore di comprimibilità (Z)
![]()
il cui valore è tanto diverso da 1 quanto più il suo comportamento si discosta dall'idealità.
È possibile costruire un diagramma relativo a diversi tipi di gas mantenuti alla stessa temperatura, nel quale sono riportati in ascissa i valori della pressione e in ordinata i valori di Z:
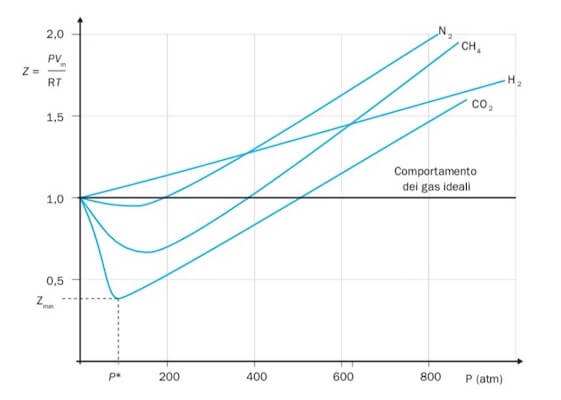
Fattore di comprimibilità a 300 K di alcuni gas; all'aumentare della pressione lo scostamento di comportamento dall'idealità diventa sempre più evidente.
Come si può notare dal grafico un gas ideale dovrebbe avere un valore di Z = 1 a qualsiasi pressione. I gas a comportamento reale mostrano invece uno scostamento del valore di Z = 1 che può essere negativo (come per N2, CH4 e CO2) a basse pressioni o positivo.
Nel seguente grafico viene invece riportato il fattore di comprimibilità Z dell'azoto misurato a diverse temperature.
Come si può osservare, ad elevate temperature, il valore di Z si avvicina a quello di un gas ideale (Z = 1) a riprova del fatto che - ad elevate temperature - il comportamento di un gas si avvicina all'idealità.
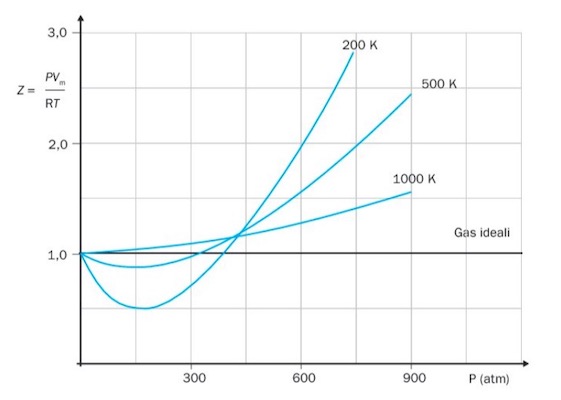
Fattore di comprimibilità Z dell'azoto a diverse temperature.
In ogni caso, non esiste un passaggio netto fra gas ideale e gas reale; in pratica ogni gas può comportarsi da gas ideale (bassa pressione, alta temperatura) e da gas reale (alta pressione, bassa temperatura), passando da un comportamento all'altro attraverso una continua diminuzione di carattere ideale ed un continuo aumento di carattere reale; questo comportamento riflette il crescente effetto delle interazioni con l'aumentare della pressione (cioè con il progressivo avvicinamento fra le particelle del gas) e con il diminuire della temperatura (cioè con la progressiva diminuzione della energia cinetica media delle particelle).
Equazione di van der Waals per i gas reali
L'equazione di stato dei gas ideali
![]()
in cui: P = pressione ; V = volume ; n = quantità di sostanza ; T = temperatura, è valida solo per gas che hanno un comportamento che si avvicina a quello di un gas ideale.
J. D. van der Waals modificò opportunamente l'equazione di stato dei gas ideali in relazione alle due differenze essenziali fra gas reali e gas ideale:
1) nei gas reali il volume materialmente occupato dalle molecole non è trascurabile rispetto al volume del recipiente in cui è contenuto il gas;
2) nei gas reali fra le particelle gassose esistono interazioni (forze attrattive o repulsive) non trascurabili.
L'equazione di stato dei gas ideali risulta così modificata nel caso di gas reali:
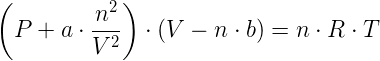
in cui a e b sono due costanti caratteristiche del gas: a è un fattore di proporzionalità, mentre b è il volume materialmente occupato da una mole di gas (covolume). I valori di a e b sono noti per tutte le specie gassose: ad esempio, per l'anidride carbonica CO2, a = 3,60 mentre b = 0,043. Tale equazione prende il nome di equazione di stato per i gas reali o legge di van der Waals.
L'equazione precedente può anche scriversi (per una mole di gas) nel seguente modo:
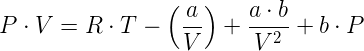
Tale equazione mostra che l'equazione di van der Waals aggiunge al prodotto R·T dell'equazione del gas ideale (P · V = R · T) tre termini correttivi, uno negativo e due positivi; l'entità della correzione dovuta a questi termini diventa trascurabile andando verso le basse pressioni (basso valore di P, alto valore di V) e acquista invece valore sempre maggiore andando verso le alte pressioni.
Passando dall'equazione di stato dei gas ideali a quella dei gas reali si è passati da un'equazione unica, valida per ogni gas a comportamento ideale, ad un'equazione valida ancora nella sua forma generale per tutti i gas reali ma che, per la presenza delle costanti a e b rappresenta tanti casi diversi quanti sono i gas in questione.
Link correlati:
Esercizio sul calcolo del covolume di un gas
Esercizi svolti e commentati sui gas
Che cosa sono i gas combustibili?
Che cosa sono i gas criogeni?
Esercizio svolto e commentato sul calcolo della densità di un gas
Che cos'è il gas di città?
Studia con noi