Gas ideale o perfetto
Generalità e proprietà dei gas ideali
Le leggi che regolano il comportamento dei gas, sistemi costituiti da un numero elevatissimo di particelle animate da moto caotico, vengono interpretate a partire da considerazioni di natura statistica, a cui sottostanno anche i gas ideali, ovvero ipotetici gas che rispettano alcuni requisiti.
Come prerequisito fondamentale per comprendere la lezione sui gas ideali è sapere che le particelle di un gas si muovono a grande velocità e in tutte le direzioni e nel loro moto caotico urtano continuamente tra loro e urtano le pareti del recipiente.
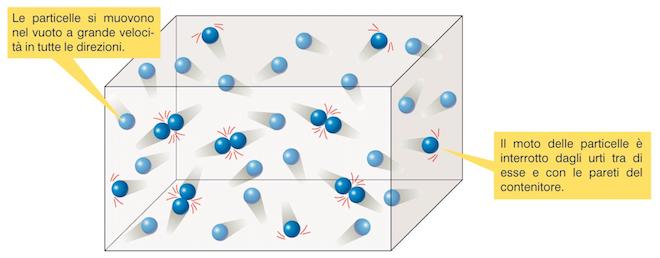
Moto caotico delle particelle di un gas: le particelle di un gas si muovono nel vuoto a grande velocità e in tutte le direzioni; il moto delle particelle è interrotto dagli urti tra di esse e con le pareti del recipiente.
Cos'è un gas ideale?
Un gas ideale (detto anche gas perfetto) è un gas ipotetico che rispetta i seguenti requisiti:
1) Le sue particelle hanno volume nullo: il volume delle particelle del gas è trascurabile rispetto al volume del gas (e quindi del recipiente che lo contiene).
2) Le forze attrattive tra le particelle sono nulle per cui ogni particella è indipendente dalle altre.
3) Le collisioni tra le particelle del gas o tra le particelle del gas e le pareti del recipiente sono perfettamente elastiche. Una collisione elastica è una collisione nella quale la dispersione di energia è nulla.
4) L'energia cinetica media delle particelle aumenta all'aumentare della temperatura assoluta del gas.
Moto caotico delle particelle di un gas.
È evidente che un gas perfetto nella realtà non esiste; in opportune condizioni sperimentali (essenzialmente bassa pressione), il comportamento dei gas reali si avvicina però a quello dei gas ideali. Comunque sia, buona parte dei gas, già nelle condizioni ambiente di temperatura e di pressione obbediscono soddisfacentemente (entro lo 0,1%) alle leggi del gas ideale.
Considerare un gas ideale permette di trattare le particelle di un gas come masse puntiformi trascurando le forze intermolecolari che dipendono dalla loro natura chimica. L'assenza di interazioni fra le particelle che costituiscono il gas fa sì che le leggi che ne governano il comportamento prescindano dalla natura chimica delle particelle stesse.
Pertanto le leggi del gas ideale non sono leggi chimiche ma leggi fisiche, statistiche, valide per un sistema costituito da un gran numero di particelle, di volume trascurabile , indipendenti tra loro, e che si muovano a caso.
La natura statistica di queste leggi trova fondamento nel fatto che anche una piccolissima quantità di gas è sempre costituita da un enorme numero di particelle (si consideri ad esempio che in 1 mg di idrogeno sono contenute circa 3 · 1020 molecole di H2).
È pertanto possibile descrivere il comportamento di un gas tenendo conto unicamente delle variabili di stato (temperatura, pressione, volume) senza dover descrivere la dinamica delle interazioni intermolecolari.
Stato standard per specie gassose
Lo stato standard per specie gassose è quello del gas ideale alla pressione di 1 atmosfera e alla temperatura T di 298,16 K.
Tale stato standard non è realizzabile: infatti un gas a pressione P=1 atm non può essere considerato ideale perché fra le molecole esistono interazioni (anche se modeste) e d'altra parte per eliminare queste occorrerebbe scendere a pressioni minori di 1 atm; lo stato standard dei gas è perciò uno stato ipotetico.
Equazione di stato dei gas ideali
Se ad una massa di gas applichiamo separatamente la legge di Boyle, la legge di Charles, la legge di Gay-Lussac e la legge di Avogadro, è possibile dedurre una equazione, detta equazione di stato dei gas ideali o gas perfetti, nella quale la pressione, il volume, la temperatura assoluta e la quantità di sostanza del gas risultano matematicamente legati fra loro dalla seguente equazione:
P · V = n · R · T
in cui R è una costante nota come costante dei gas, che assume valori diversi a seconda delle unità di misura utilizzate per esprimere P, V, n e T.
Tale equazione, nota come equazione di stato dei gas perfetti o dei gas ideali, è così denominata perché è stata ottenuta ammettendo la validità generale delle leggi di Boyle, di Charles, di Gay-Lussac e di Avogadro, validità che invece, come abbiamo più volte sottolineato, non è sempre verificata per i gas reali.
Comunque, in prima approssimazione, questa equazione può essere anche applicata ai gas reali, soprattutto se essi si trovano a bassa pressione e ad elevata temperatura.
Esercizi sui gas
Li trovi online e svolti al seguente link: esercizi sui gas.
Link correlati:
Che cosa studia la meccanica dei fluidi?
Che cosa sono i gas combustibili?
Esercizio sul calcolo dell'energia cinetica media delle particelle di un gas
Esercizio svolto e commentato sul calcolo della densità di un gas
Che cos'è il gas di città?
Che cosa studia la gasdinamica?
Quali sono le proprietà dei gas ionizzati?
Studia con noi